
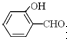
 形成分子内氢键,而
形成分子内氢键,而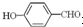 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.分析 (1)O元素原子核外有8个电子,其2p轨道上有4个电子,分别位于3个轨道上;
(2)作用力:化学键>氢键>分子间作用力;
(3)分子间氢键的作用力大于分子内氢键的作用力;
(4)H3O+中O原子价层电子对个数=3+$\frac{6-1-3×1}{2}$=4,根据价层电子对互斥理论判断O原子杂化方式;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答 解:(1)O元素原子核外有8个电子,其2p轨道上有4个电子,分别位于3个轨道上,所以氧元素基态原子核外未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为①>③>②,故答案为:①>③>②;
(3)含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键,
故答案为: 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(4)H3O+中O原子价层电子对个数=3+$\frac{6-1-3×1}{2}$=4,根据价层电子对互斥理论判断O原子采用sp3杂化;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
点评 本题考查原子杂化、氢键、原子核外电子排布等知识点,侧重考查学生分析判断及计算能力,难点是价层电子对个数的计算方法,注意:氢键不属于化学键,属于分子间作用力,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
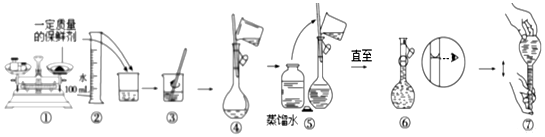
科目:高中化学 来源: 题型:实验题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
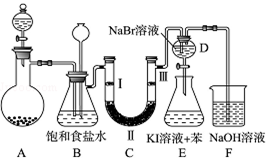
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列化合物属于弱电解质的是( )
A.HCl B.Ba(OH)2 C.CO2 D.NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com