
【题目】氨是现代社会中必不可少的原料。催化合成氨是氮循环的重要一环。
(1)目前工业上用氢气和氮气合成氨。
①写出工业合成氨的化学方程式_____________________________。
② NH3和PH3的分解温度分别是600℃和500℃,热稳定性差异的原因是
____________________________________________________ ,
元素的非金属性逐渐减弱,氢化物稳定性逐渐减弱。
(2)工业合成氨主要经过原料气(N2、H2)的制取、净化、压缩合成三大过程。
①天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

1mol CH4(g)通过蒸汽转化为CO2(g)和H2(g)的热化学方程式是
______________________________________________________。
②CO变换过程可由Fe2O3催化完成。将下述催化过程补充完整:
i.3Fe2O3 + CO = 2Fe3O4 + CO2
ii._____________________________________________
③醋酸铜氨液可以吸收原料气中CO等少量杂质。吸收CO反应为:
[Cu(NH3)2]Ac(aq)+NH3(aq)+CO(g)==[Cu(NH3)3CO]Ac(aq) △H <0。
下图表示压强和温度对醋酸铜氨液吸收CO能力的影响。L(L1、L2),X可分别代表压强或温度。

i.X代表的物理量是_________。
ii.判断L1、L2的大小关系并简述理由_________________________________________。
(3)电化学法也可合成氨。下图是用低温固体质子导体作为电解质,用Pt-C3N4作阴极催化剂电解H2(g)和N2(g)合成NH3的原理示意图:
①Pt-C3N4电极反应产生的气体是NH3和______。

②实验表明,其它条件不变,逐渐增加电解电压,氨气生成速率会逐渐增大,但当电解电压高于1.2V后,氨气生成速率反而会随电压升高而下降,分析其可能原因_________________________。
【答案】 ① N2 + 3H2 ![]() 2NH3 N、P都位于VA族。同主族元素,从上到下,原子半径逐渐增大 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H = +165.4 kJ/mol 2Fe3O4+H2O=3Fe2O3+H2 .压强 L1<L2。吸收CO反应放热(△H <0),当压强一定时,温度降低,醋酸铜氨溶液CO吸收能力增大。 H2 电压高于1.2V后,2H++2e-=H2↑(H+得电子生成H2)反应使生成氨气速率下降。
2NH3 N、P都位于VA族。同主族元素,从上到下,原子半径逐渐增大 CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H = +165.4 kJ/mol 2Fe3O4+H2O=3Fe2O3+H2 .压强 L1<L2。吸收CO反应放热(△H <0),当压强一定时,温度降低,醋酸铜氨溶液CO吸收能力增大。 H2 电压高于1.2V后,2H++2e-=H2↑(H+得电子生成H2)反应使生成氨气速率下降。
【解析】试题分析:(1)
①工业上用氢气和氮气高温高压合成氨气。
② 同主族元素从上到下非金属性减弱。
(2)①根据盖斯定律计算焓变;
②总反应减反应i可得反应ii的方程式;
③i. 根据温度、压强对平衡移动的影响分析;根据x增大,醋酸铜氨液吸收CO能力增大分析。
ii. 根据吸收CO反应放热(△H <0),当压强一定时,温度降低,醋酸铜氨溶液CO吸收能力增大判断L1、L2的大小。
(3)①根据 Pt-C3N4电极的阴极,发生还原反应,Pt-C3N4电极反应产生的气体是NH3和H2。
②电压高于1.2V后,发生2H++2e-=H2↑反应,所以。
解析:(1)①用氢气和氮气高温高压合成氨气的方程式为N2 + 3H2 ![]() 2NH3。
2NH3。
②N、P都位于VA族,同主族元素从上到下非金属性减弱,氢化物稳定性逐渐减弱,所以NH3和PH3的分解温度分别是600℃和500℃。
(2)①根据第一步反应的图示,CH4(g)+H20(g)=CO(g)+3H2(g) △H=+206.4kJ/mol;根据第一步反应的图示,CO(g)+H20(g)=CO2(g)+3H2(g) △H=-41.0kJ/mol;根据盖斯定律,CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H = +165.4 kJ/mol ;
②总反应减反应i可得反应ii的方程式,所以反应ii的方程式为2Fe3O4+H2O=3Fe2O3+H2;
③i. [Cu(NH3)2]Ac(aq) + NH3(aq) + CO(g) == [Cu(NH3)3CO]Ac(aq) △H <0,升高温度,平衡逆向移动,增大压强平衡正向移动,根据图示 x增大,醋酸铜氨液吸收CO能力增大,x表示压强。
ii. 根据吸收CO反应放热(△H <0),当压强一定时,温度降低,醋酸铜氨溶液CO吸收能力增大所以L1<L2。
(3)①根据 Pt-C3N4电极的阴极,发生还原反应所以。
②电压高于1.2V后,发生2H++2e-=H2↑反应,使生成氨气速率下降。


科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)Y在周期表中位于_____________;Z4+的核外电子排布式为____________。
(2)X的该种氢化物分子构型为_______,X在该氢化物中以________方式杂化。X和Y形成的化合物的熔点应该________(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是___________________________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____________ m。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物能用相应元素的单质直接化合生成的是
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2S ⑧FeCl3
A. ②③⑤⑦⑧ B. ①④⑥⑦ C. ①②③⑦⑧ D. ②③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 水玻璃可用作建筑黏合剂 B. 硫酸亚铁可用于生产防治缺铁性贫血的药剂
C. 碳酸钠可用于治疗胃酸过多 D. 碘化银可用于人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 保存FeCl2溶液时,常加入少量铁粉 B. 用10mL量筒量取6.4mL的稀盐酸
C. 用溴水除去甲烷中的少量乙烯 D. 用分液漏斗分离苯和汽油的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下转化关系中,元素X、Y是短周期同主族元素,元素Z是过渡元素。

已知:①Z2X、Z2Y不溶于水
②浓硝酸具有强氧化性,反应中常被还原成二氧化氮气体
下列说法不正确的是
A. Z2X是Cu2S、Z2Y是Cu2O
B. 步骤①发生的反应,其离子方程式可能为Cu2S+12H++10NO3ˉ = 2Cu2++10NO2↑+SO42ˉ+6H2O
C. 步骤②发生的反应,其离子方程式为H++OHˉ=H2O、Cu2++2OHˉ=Cu(OH)2↓
D. 步骤③发生的反应,说明葡萄糖具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
![]()
实验过程如下:在容积为l00mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚。回答下列问题:
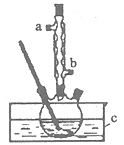
(1)合成粗产品时,液体试剂加入顺序是_________________。
(2)实验中冷凝水应从____口流出(填“a”或‘‘b”)。
(3)为保证反应温度恒定在135°C,装置C中所盛液体必须具有的物理性质为________。
(4)加热时间过长或温度过高,反应混合液会变黑,写出用浓NaOH溶液吸收有毒尾气的离子方程式________________。
(5)得到的正丁醚粗产品依次用8 mL50%的硫酸、10 mL水萃取洗涤。该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、________________________。
(6)本实验最终得到6.50g正丁醚,则正丁醚的产率是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为M g/mol,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则 ![]() 表示的是( )
表示的是( )
A. V L该气体的质量(以g为单位) B. 1 L该气体的质量(以g为单位)
C. 1 mol该气体的体积(以L为单位) D. 1 L该气体的物质的量(以mol为单位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com