
 ��һ�������½��е����л�ѧ��Ӧ����������µ�ת����ϵ�ش��������⣮��֪A��B��C�о�����ͬ��Ԫ�أ�
��һ�������½��е����л�ѧ��Ӧ����������µ�ת����ϵ�ش��������⣮��֪A��B��C�о�����ͬ��Ԫ�أ�


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ���� | ���� | �� |
| �۵㣨�棩 | -210.01 | -252.77 | -77.74 |
| �е㣨�棩 | -195.79 | -259.23 | -33.42 |
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
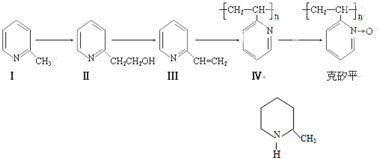
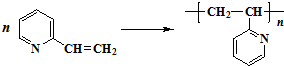
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�Ϻϳɰ�����һ�������½������·�Ӧ��
N2��g��+3H2��g��![]() 2NH3��g������H=��92.2kJ/mol���䲿�ֹ����������£�
2NH3��g������H=��92.2kJ/mol���䲿�ֹ����������£�

��Ӧ��ϵ�и���ֵIJ������ʼ��±���
| ���� | ���� | ���� | �� |
| �۵㣨�棩 | ��210.01 | ��252.77 | ��77.74 |
| �е㣨�棩 | ��195.79 | ��259.23 | ��33.42 |
�ش��������⣺
��1��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K= �������¶����ߣ�
Kֵ ��������С�����䣩��
��2��ƽ�ⳣ��KֵԽ���� ������ţ���
A��N2��ת����Խ�� B��NH3�IJ���Խ��
C��ԭ����N2�ĺ���Խ�� D����ѧ��Ӧ����Խ��
��3���ϳɰ���Ӧ��ƽ�ⳣ����С�������ڹ�ҵ�ϲ�ȡ����ѭ�������̡�����Ӧ��ͨ���ѻ��������¶Ƚ��͵� ʹ �������������ѭ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�Ϻϳɰ�����һ�������½������·�Ӧ��
N2��g��+3H2��g��2NH3��g������H=��92.2kJ/mol���䲿�ֹ����������£�
��Ӧ��ϵ�и���ֵIJ������ʼ��±���
| ���� | ���� | ���� | �� |
| �۵㣨�棩 | ��210.01 | ��252.77 | ��77.74 |
| �е㣨�棩 | ��195.79 | ��259.23 | ��33.42 |
�ش��������⣺
��1��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K= �������¶����ߣ�
Kֵ ��������С�����䣩��
��2��ƽ�ⳣ��KֵԽ���� ������ţ���
A��N2��ת����Խ�� B��NH3�IJ���Խ��
C��ԭ����N2�ĺ���Խ�� D����ѧ��Ӧ����Խ��
��3���ϳɰ���Ӧ��ƽ�ⳣ����С�������ڹ�ҵ�ϲ�ȡ����ѭ�������̡�����Ӧ��ͨ���ѻ��������¶Ƚ��͵� ʹ �������������ѭ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�߶��^����������ѧ�Ծ��������棩 ���ͣ������
��14�֣���ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������
CO(g)��H2O(g)  CO2(g)��H2(g)
CO2(g)��H2(g)
ij�о�С��ֱ��������Ϊ2 L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
|
���� ��� |
�¶� /�� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ���ʱ��/min |
��ƽ��ʱ��ϵ�����ı仯/kJ |
||
|
CO |
H2O |
CO2 |
H2 |
||||
|
�� |
650 |
1 |
2 |
0.4 |
0.4 |
5 |
16.4kJ |
|
�� |
650 |
2 |
4 |
|
|
t1 |
Q1 kJ |
|
�� |
900 |
2 |
4 |
1.6 |
1.6 |
t2 |
Q2 kJ |
��1�������������з�Ӧ��ƽ�ⳣ��K= ��������������λС������
��2���������з�Ӧ��ƽ��ʱ��CO��ת����Ϊ ��
��3���������з�Ӧ��ƽ�����ʱ�䣬��ѧ��Ӧ����v (H2) = ��
��4���÷�Ӧ������ӦΪ ������ȡ����ȡ�����Ӧ�������� ��
��5������������ȷ���� ������ĸ��ţ���
a��ƽ��ʱ�������ٺ���������CO2������������
b����Ӧ��ƽ��״̬ʱ��Q2 > Q1 > 32.8 kJ
c���ﵽƽ���ʱ�䣺t2 > t1>2.5 min
d���÷�Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ��CO(g)��H2O(g)  CO2(g)��H2(g) ��H����41 kJ/mol
CO2(g)��H2(g) ��H����41 kJ/mol
��6���������з�Ӧ���е�t minʱ����û��������CO2�����ʵ���Ϊ0.6 mol������200 mL 5 mol/L��NaOH��Һ������ȫ���գ��õ�����Һ���������ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com