
【题目】钇钡铜氧(YBa2Cu3O7-x)类高温超导材料(其中Y显+3价,Cu显+2、+3价)可由Y2(CO3)3、BaCO3和CuCO3混合在高温下反应制得。回答下列问题:
(1)Y(钇)是一种稀土金属元素,与Sc(钪)同族相邻。X在元素周期表中的位置是_______,目前的周期表中,该族共有______种元素。
(2)基态Cu3+的电子排布式为________。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是____________________________________。
(3) CO32-中C原子釆取_______杂化;第一电离能:C_____O(填“>”或“<”)。
(4)某种钇钡铜氧材料中x=0.2,则n(Cu3+):n(Cu2+)=________。
(5)如图是另一种钇钡铜氧超导材料的晶胞结构示意图,其化学式为______,晶体中Y3+的坐标是______;若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则该晶体的密度为____g·cm-3。

【答案】 第5周期IIIB族 32 [Ar]3d8 Cu2O中Cu+的3d能级为全充满状态,较稳定 sp2 < 1:4 YBa2Cu3O7 (0,0,0) M/a2bNA
【解析】(1)Sc是第21号元素,处于周期表的第4周期IIIB族,所以Y在第5周期IIIB族。该族中包括Sc、Y、镧系(15个元素)、锕系(15个元素)一共32种元素。
(2)Cu为第29号元素,基态排布为[Ar]3d104s1,所以Cu3+应该失去3个电子变为:[Ar]3d8。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是Cu2O中Cu为+1价,失去最外层的1个电子,变为[Ar]3d10的结构,此时3d能级达到全满的稳定结构,所以Cu2O的稳定性较强。
(3)根据价层电子对互斥理论,CO32-的中心碳原子的价电子对为3+(4-2×3+2)/2=3对,配位数为3,所以离子为平面三角形结构,碳原子的杂化类型为sp2杂化。同周期从左向右第一电离能逐渐增大,所以第一电离能:C<O。
(4)某种钇钡铜氧材料中x=0.2,则化学式为:YBa2Cu3O6.8,设其中Cu3+和Cu2+分别有X和Y个,所以有X+Y=3;再根据化合价代数之和为0,得到3+2×2+3X+2Y=2×6.8;解得:X=0.6,Y=2.4;所以n(Cu3+):n(Cu2+)=1:4。
(5)Y有8个在顶点,所以Y有:8×1/8=1个;Ba有8个在棱边上,所以Ba有8×1/4=2个; Cu都在晶胞内部有3个;O有2个在晶胞内,另外10个都在晶胞的面上,所以O有:2+10×1/2=7个;由上晶体的化学式为:YBa2Cu3O7。Y位于晶胞的顶点,所以其坐标为(0,0,0)。若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则晶胞的质量为M/NA g,晶胞的体积为a2b cm3,所以晶胞的密度为:M/a2bNA g·cm-3。


科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
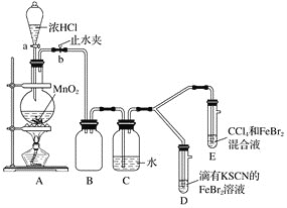
(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
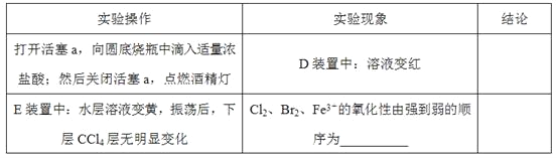
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现节能减排,氯碱工业中相关物料的传输与转化关系如下图所示(电极均为惰性电极,图中未标出)。下列说法中正确的是
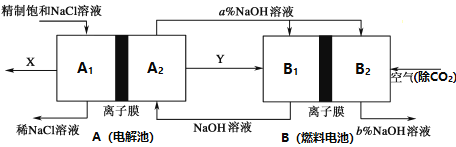
A. A1区域为阴极区,电解过程中,溶液pH增大
B. B2区域中发生的电极反应为O2+4e-+4H+=2H2O
C. 若两池中所用离子膜类型相同,则a<b
D. 利用整套装置最终获得的产品是氢气、氧气和烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锌及氧化锌都是重要的含锌化合物。氢氧化锌是难溶于水的白色固体,在水中的电离形式与Al(OH)3相似。常温下,水溶液中不同形式含锌微粒物质的量浓度(对数值lgc)与pH的关系如下图所示。回答下列问题:

(1)向ZnCl2溶液中滴加NaOH溶液至过量,看到的现象是___________________________;实验室中若用Zn、NaOH溶液和稀盐酸制备Zn(OH)2,最佳方案是______________________。
(2)根据图中数据可知,常温下,Ksp[Zn(OH)2]=_________。
(3)工业上可用菱锌矿(主要成分是ZnCO3,还含有少量的Fe2O3、FeO、CuO等杂质)为原料制取氧化锌。工艺流程如下:

①氧化锌是__________(填“酸性”或“碱性”或“两性”)氧化物。上述流程中,“试剂甲”参与反应的离子方程式为______________________________________。
②可以利用碳酸锌代替氨水来调节溶液的pH并得到氢氧化铁沉淀,原因是________;若“乙溶液”中c(Fe3+)为2.6×10-18mol/L,则c(Zn2+)为______mol/L(已知:Ksp[Fe(OH)3]=2.6×10-39)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于炔烃的下列描述正确的是
A. 分子里含有碳碳三键的一类脂肪烃叫炔烃
B. 炔烃分子里的所有碳原子都在同一直线上
C. 炔烃易发生加成反应,也易发生取代反应
D. 炔烃可以使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I | 试剂 | 现象 | |
滴管 | 试管 | ||
2mL | 1 mol·L-1FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
1 mol·L-1NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 | ||
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+![]() Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
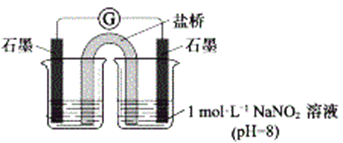
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物B.该物质一定含钠离子
C.该物质一定是金属钠D.不能确定该物质是否含钾元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com