
将V mL NO和NO2的混合气体通过足量水吸收后,得到a mL无色气体A,将A气体与等体积O2混合,再通过水充分吸收后,收集到5 mL无色气体B。试通过计算回答:
(1)A、B各为何种气体?
(2)A气体的体积是多少?
(3)V的取值范围是多少?
(1)A、B分别为NO、O2 (2)20 mL (3)(5,15)
因为3NO2+H2O====2HNO3+NO
所以a mL无色气体为NO
将NO气体与氧气等体积混合,通过水发生的反应为:4NO+3O2+2H2O====4HNO3,由于氧气过量,所以收集到的5 mL无色气体B是氧气
4NO + 3O2+2H2O====4HNO3
4 mL 3 mL
V(NO) V(NO)-5 mL
V(NO)=20 mL
若V mL气体全部是NO时,V=5,由于是两种气体的混合气体,故V的取值大于5。
若VmL气体全部是NO2时
3NO2+H2O====2HNO3+NO
3 mL 1 mL
VmL 5 mL
V=15
由于是两种气体的混合气体,故V的取值小于15。


科目:高中化学 来源:2012-2013学年四川省成都外国语学校高一下学期期中考试化学试卷(带解析) 题型:填空题
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | | | | |
| ③ | | 粗颗粒 | | |
| ④ | | | |
 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市松江区高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
粗颗粒 |
|
|
|
④ |
|
|
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
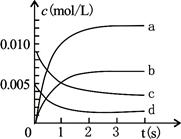
(3)右图中表示NO2变化的曲线是 ;
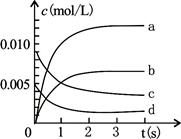
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
查看答案和解析>>
科目:高中化学 来源:专项题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将m mL NO2和NO混合气通入过量饱和NaHCO3溶液中,再使逸出的气体通过装有Na2O2(过量)的干燥管,最后收集到n mL b气体,据NO2和NO的体积比推断b的成分,正确的是 ( )
A.当V(NO2):V(NO)=3:1时,b为NO2
B.当V(NO2):V(NO)<3:1时,b为O2
C.当V(NO2):V(NO)>3:1时,b为NO和NO2
D.当V(NO2):V(NO)=3:1时,b为NO2和O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com