
生产自来水的流程如图所示:回答下列问题。
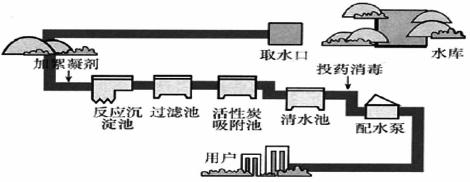
(1)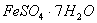 是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
(2)天然水中含有较多的钙、镁离子,称为硬水。生活中常用__________方法来降低水的硬度。
(3)过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是__________。
(4)“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式__________。
(5)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
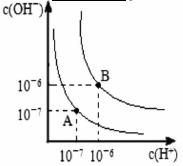
①100℃时1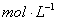 的NaOH溶液中,由水电离出的c(H+)=________
的NaOH溶液中,由水电离出的c(H+)=________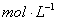 ,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
②25℃时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有__________(填字母)。
A. 溶液中一直存在: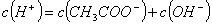
B. 加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C. 加入过程中,溶液中所有离子浓度逐渐增大
D. 加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E. 用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂
科目:高中化学 来源: 题型:
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D.相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种则这种烃可能是( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃 ③分子中具有12个氢原子的烷烃 ④分子中具有6个碳原子的烷烃 ⑤分子中具有8个碳原子的烷烃
A. ①②③ B. ③⑤ C. ③④⑤ D. ②③④⑤
Ⅱ(8分)有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式;
(3)试写出该有机物可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A. 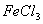 溶液与
溶液与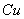 的反应:
的反应: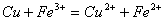
B. 过量的二氧化碳通入偏铝酸钠溶液中:
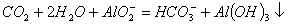
C. 用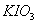 氧化酸性溶液中的
氧化酸性溶液中的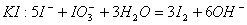
D. 用稀硝酸洗涤试管内壁的银镜: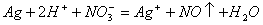
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL 3mol/L的X溶液 B.20℃30mL 2mol/L的X溶液
C.20℃10mL 4mol/L的X溶液 D.10℃10mL 2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
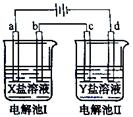
右图所示的电解池I和II中,a、b、c和d均为石墨电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是( )
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A~G是中学化学中常见的物质,这些物质有如图所示的转化关系(部分反应物、生成物没有列出)。其中A、B、F含有一种相同的元素,C、D、G含有一种相同的元素,F具有磁性,G为黑色非金属单质。
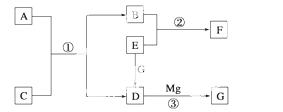
(1)物质A溶解于盐酸,然后加入KSCN溶液,溶液不变色,再滴加几滴氯水, 溶液变为血红色,由此推知A的化学式为__________。
溶液变为血红色,由此推知A的化学式为__________。
(2)反应③的化学方程式是_______________________ _______________________。
_______________________。
(3)写出下列物质的化学式: E__________、F__________。
E__________、F__________。
(4)若C是一种气体,在温度为1 100 ℃的某固定容积的密闭容器中发生反应:A(s)+C(g)B(s)+D(g) ΔH=a kJ·mol-1(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量________(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率________(选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__________(选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若c(C)=0.100 mol·L-1,则c(D)=________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C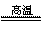 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com