
下表是元素周期表中短周期部分,表中所列字母分别代表一种元素,回答有关问题.(均用元素符号或化学式表示)
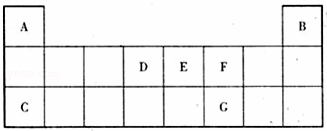
(1)A﹣G中非金属性最强的元素是; 最不活泼的元素是;A、C的最高价氧化物对应水化物中,碱性更强的是N
(2)A和D可形成一种最10电子化合物,它的化学式为CH4这种化合物含键.(填“离子键”或“共价键”)
(3)C和F离子半径较小的是(填化学式)
(4)下图是A2与F2发生反应生成A2F的途径和三个状态的能量(E)则:
①步骤l是(填“吸热”或“放热”)过程.
②比较E1、E2、E3的大小.(由大到小顺序排列)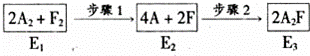
(5)元素E的氢化物能与它的最高价氧化物的水化物反应生成一种盐,化学方程式为,该反应产物属于化合物(填“离子”或“共价”)
考点: 元素周期律和元素周期表的综合应用.
分析: 由元素在周期表中的位置可知,A为H元素,B为He,C为Na;D为碳元素;E为N元素;F为O元素;G为D元素.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱;
稀有气体原子最外层为稳定结构,化学性质最不活泼;
金属性越强,最高价氧化物对应水化物的碱性越强;
(2)A和D可形成一种最10电子化合物为CH4,不同非金属元素原子之间形成的共价键;
(3)电子层结构相同的离子,核电荷数越大,离子半径越小;
(4)化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量;放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合氢气燃烧为放热反应判断;
(5)元素E的氢化物、最高价氧化物的水化物分别为NH3、HNO3,二者反应生成NH4NO3.
解答: 解:由元素在周期表中的位置可知,A为H元素,B为He,C为Na;D为碳元素;E为N元素;F为O元素;G为D元素.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故A﹣G中非金属性最强的元素是O元素;
稀有气体He原子最外层为稳定结构,化学性质最不活泼;
H元素氧化物为水,呈中性,Na元素最高价氧化物对应水化物为NaOH,呈碱性,
故答案为:O;He;NaOH;
(2)A和D可形成一种最10电子化合物为CH4,含有共价键,故答案为:CH4;共价键;
(3)电子层结构相同的离子,核电荷数越大,离子半径越小,故离子半径:O2﹣>Na+,故答案为:Na+;
(4)①步骤l中化学键断裂形成原子,应是吸热过程,故答案为:吸热;
②步骤1为吸热过程,故E2>E1,步骤2是原子之间形成化学键生成新物质,放出热量,故E2>E3,由于氢气燃烧为放热反应,故E1>E3,故E2>E1>E3,故答案为:E2>E1>E3;
(5)元素E的氢化物、最高价氧化物的水化物分别为NH3、HNO3,二者反应生成NH4NO3,化学方程式为:NH3+HNO3=NH4NO3,NH4NO3属于离子化合物,故答案为:NH3+HNO3=NH4NO3;离子.
点评: 本题考查元素周期表、元素周期律、微粒半径比较、反应热等,题目较为综合,难度不大,注意基础知识的理解掌握.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
从固体混合物A出发可以发生如下框图所示的一系列变化。
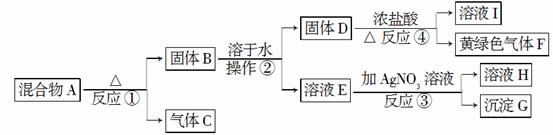
G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色的钴玻璃观察)。回答下列问题:
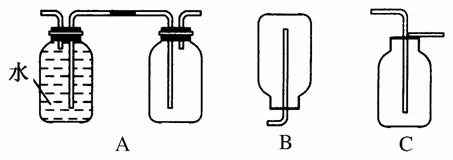
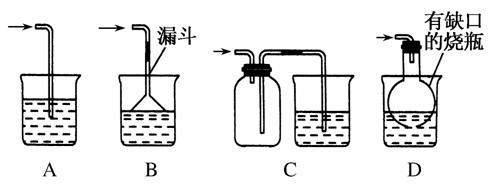
(1)在实验室中收集气体C,可选择如图装置中的________。
(2)操作②的名称是________。在操作②中所使用的玻璃仪器的名称是________。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的目的是________________________________________。
(3)写出反应①的化学方程式、反应④的离子方程式:
反应①:_____________________________________________,
反应④:___________________________________________。
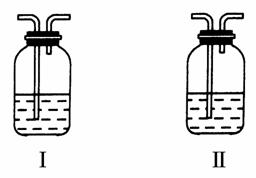
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它依次通过如图中的Ⅰ、Ⅱ装置,其中瓶Ⅰ中盛放的是________,瓶Ⅱ中盛放的是________。
(5)实验中必须吸收多余的气体F,以免污染空气。下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,合理的装置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用.
(1)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式:.
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:;为抑制肼的分解,可采取的合理措施有(任写一种).
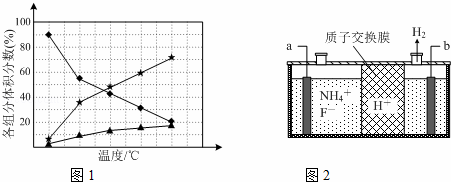
(2)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示.
①氮化硅的化学式为
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
查看答案和解析>>
科目:高中化学 来源: 题型:
元素R的最高价含氧酸的化学式为HnRO2n﹣2,则在气态氢化物中R元素的化合价为()
A. 12﹣3n B. 3n﹣12 C. 3n﹣10 D. 6﹣3n
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:
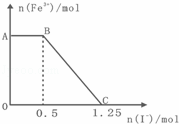 2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液(假设I﹣与KMnO4反应的氧化产物为I2),混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液(假设I﹣与KMnO4反应的氧化产物为I2),混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I﹣═2Fe2++I2通电
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol
D.以Pt为电极材料电解C点的溶液,总反应式为2H2O 2H2↑+O2↑,则当外电路电子流通4mol时两极产生的气体总体积一定是67.2L
2H2↑+O2↑,则当外电路电子流通4mol时两极产生的气体总体积一定是67.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下合成乙烯。
6H2(g)+2CO2(g)  C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
 (1)乙烯是___________分子。(填极性或非极性)
(1)乙烯是___________分子。(填极性或非极性)
(2)请在方程式上标出该反应电子转移的方向和数目。
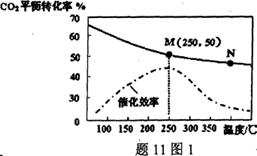
(3)温度对CO2的平衡转化率和催化剂催化效率的影
响如题11图1,下列说法正确的是___________。
A.此反应随温度升高,反应速率一定加快
B.平衡常数:KM>KN
C.M点CO2的平衡转化率受温度、催化剂的共同影响
 (4)若投料比n(H2):n(CO2)=3:1,图中M点乙烯的体积分数为___________ (保留两位有效数字)。
(4)若投料比n(H2):n(CO2)=3:1,图中M点乙烯的体积分数为___________ (保留两位有效数字)。
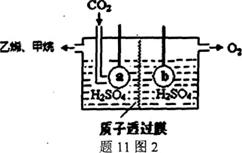
(5)电解法制取乙烯装置如题11图2,电极a接电源的
___________极,生成乙烯的电极反应式为___________。
当左侧有33.6L(标准状况)CO2反应时,左右两侧溶液
质量差|△m右|﹣|△m左|=36g,则乙烯的产率为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
|
| A. | 钠、钾着火时可用水灭火 |
|
| B. | 面粉厂或加油站不必严禁烟火 |
|
| C. | 氨气泄漏时可喷洒大量水进行处理 |
|
| D. | 节日期间可在人群聚集的闹市燃放烟花爆竹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com