
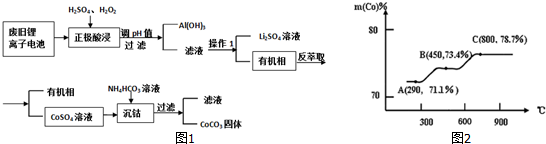
分析 正极材料酸浸,并且加入稀硫酸、双氧水,涉及的氧化还原反应有2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O、2Al+3H2SO4=Al2(SO4)3+3H2↑、2H2O$\frac{\underline{\;80℃\;}}{\;}$O2↑+2H2O;调节溶液的pH得到Al(OH)3沉淀,过滤得到滤液和Al(OH)3,通过操作1得到Li2SO4和有机相,操作1为萃取分液,然后反萃取得到有机相和CoSO4,向溶液中加入碳酸氢铵溶液,发生反应为CO32-+Co2+=CoCO3↓,
(1)在酸性条件下,LiCoO2和双氧水发生氧化还原反应,铝和硫酸发生氧化还原反应;2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O中氧化产物是氧气,根据LiCoO2和氧气之间的关系式计算;
(2)根据溶度积常数计算溶液pH;
(3)该操作是萃取、分液;
(4)浓度积大于溶度积时产生沉淀;
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质,Co(OH)2在空气中加热时,根据FeFe的氧化物,则Co的氧化物可能为Co2O3、CoO、Co3O4,Co2O3中Co的含量=$\frac{59×2}{59×2+16×3}$×100%=71.1%、CoO中Co的含量=$\frac{59}{75}×100%$=78.7%、Co3O4中Co的含量=$\frac{59×3}{59×3+16×4}$×100%=73.4%,
根据Co元素含量确定固体成分.
解答 解:(1)根据工艺流程中酸浸的过程中发生氧化还原反应有2LiCoO2+3 H2SO4+H2O2=Li2SO4+2 CoSO4+O2↑+4H2O;有Al(OH)3固体和题干中的铝箔,易推知有铝与H2SO4溶液反应,所以离子方程式为:2Al+6H+=2Al3++3H2↑;因为反应是温度80℃,还会发生双氧水制氧气的反应:2H2O$\frac{\underline{\;80℃\;}}{\;}$O2↑+2H2O,
2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O中氧化产物是氧气,1molLiCoO2完全反应生成氧气0.5mol,其质量为16g,
故答案为:2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O、2Al+3H2SO4=Al2(SO4)3+3H2↑、2H2O$\frac{\underline{\;80℃\;}}{\;}$O2↑+2H2O;16g;
(2)离子浓度等于或小于1.0×10-6时,认为其完全沉淀;c(OH-)3=$\frac{{K}_{sp}}{c(A{l}^{3+})}$=$\frac{1.13×1{0}^{-33}}{1.0×1{0}^{-6}}$,c(OH-)=10-9 mol•L-1,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5 mol•L-1,pH=5,
故答案为:5;
(3)该操作是萃取、分液,故答案为:萃取、分液;
(4)平衡移动原理,溶液中HCO3-?H++CO32- Co2+浓度与CO32- 浓度积即为浓度积大于CoCO3的Ksp 向生成沉淀的方向移动,
故答案为:HCO3-?H++CO32-,溶液中Co2+浓度与CO32- 浓度积即为浓度积大于CoCO3的Ksp 向生成沉淀的方向移动;
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质,Co(OH)2在空气中加热时,根据FeFe的氧化物,则Co的氧化物可能为Co2O3、CoO、Co3O4,Co2O3中Co的含量=$\frac{59×2}{59×2+16×3}$×100%=71.1%、CoO中Co的含量=$\frac{59}{75}×100%$=78.7%、Co3O4中Co的含量=$\frac{59×3}{59×3+16×4}$×100%=73.4%,
所以A点成分为Co2O3,在550-600℃范围内,剩余固体的成分为Co3O4和CoO,
故答案为:Co2O3;CoO、Co3O4.
点评 本题考查物质分离和提纯,涉及工业流程、氧化还原反应、信息型方程式书写、Ksp计算、物质分离和提纯、化学平衡移动原理,综合性较强,把握基本反应原理及物质性质是解本题关键,侧重考查学生分析计算能力,难点是(5)题固体成分判断,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型离子化合物 | |
| D. | W的单质有毒,能使湿润的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA | |
| C. | 常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算 | |
| D. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
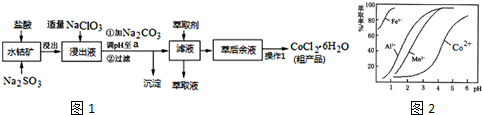
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g冰的晶体中含有氢键的数目为2 NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA | |
| D. | 1 mol C12与足量NaOH溶液反应,转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
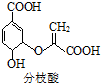
| A. | 分子中含有3种含氧官能团 | |
| B. | 可发生取代、加成、消去、加聚等反应 | |
| C. | 该物质的分子式为C10H10O6 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | |
| A | 加入NaOH溶液 | 有红褐色沉淀 |
| B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
| C | 加入酸性KMnO4溶液 | 紫色褪去 |
| D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com