
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c的最高价氧化物对应水化物可以反应
D. a和b形成的化合物不可能含共价键
科目:高中化学 来源: 题型:
【题目】用质量分数为375%的浓盐酸密度为116 g/cm3配制250mL浓度为1mol/L的稀盐酸。试回答下列问题:
(1)配制稀盐酸时,应选用容量为______mL的容量瓶;
(2)经计算需要______ mL浓盐酸,在量取时宜选用下列量筒中的______。(填字母)
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________________________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是__________(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是_______(填“偏高”、“偏低”、“无影响”)。
(5)配制完后,应将容量瓶中的稀盐酸转移到_______中存放,并贴上标签。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学物质结构知识,回答下列问题
(1) LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子的外围电子排布式为______________________。第四电离能:Ⅰ4(Co)___________I4(Fe)(填“>”或“<”)。PO43-的空间构型为______________________。
(2)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图所示,则B原子的杂化方式为______________________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,氨硼烷(NH3BH3)的结构式为______________________(标出配位键),写出一种与氨硼烷互为等电子体的分子的化学式:______________________。
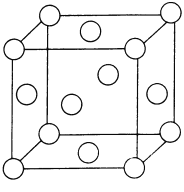
(3)常温常压下,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,1mol H3BO3晶体中含有氢键的数目为___________(用NA表示阿伏加德罗常数的值);请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:______________________。

(4)干冰晶体以及Cu晶体的结构都如图表示(○表示一个CO2分子或一个Cu原子),晶体中正八面体和正四面体空隙数的比值为___________。铜的硫化物有三种晶体,其中一种是Cu2+为面心立方最密堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两个最近的离子核间距为acm,NA表示阿伏加德罗常数的值,则该晶体的密度为___________g/cm3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验研究”的探究活动。
(1)本课题的研究对象是CH3COOH,研究目的是_____,研究方法是实验研究。
(2)该同学设计了如下方案:
A.先配制一定量的0.10mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质。
B.先配制0.01mol/L和0.10mol/L的CH3COOH,分别测他们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质。
C.先测0.10mol/LCH3COOH的pH,然后将其加热至100℃(不考虑醋酸挥发),再测pH,如果pH变小,则可证明醋酸是弱电解质。
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质。
你认为上述方案可行的是____(多项选择)
(3)请回答以下两个问题:
①弱电解质的特点是____(多项选择)
A.在水溶液中全部电离 B.在水溶液中部分电离
C.水溶液呈酸性 D.水溶液中存在电离平衡
②写出醋酸的电离方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
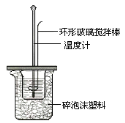
(1)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏 大、偏小、无影响”)
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由__
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )

A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)___v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____,CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com