
【题目】化学上常用AG表示溶液中的酸碱度,AG=![]() 。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:
。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:
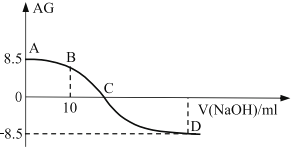
A. 点C时溶液存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B. 点B时溶液存在2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C. 25℃时,醋酸的水解常数Kh=10-4.5
D. 点D溶液的pH=11.25
【答案】C
【解析】
A.C点AG=0,说明![]() ,溶液呈现中性,溶液中之后4种离子,电荷守恒为c(Na+) +c(H+)=c(OH-) +c(CH3COO-),中性c(H+)=c(OH-),则c(Na+)=c(CH3COO-),且c(Na+)> c(H+),c(Na+)=c(CH3COO-)>c(OH-)=c(H+)正确,A不符合题意;
,溶液呈现中性,溶液中之后4种离子,电荷守恒为c(Na+) +c(H+)=c(OH-) +c(CH3COO-),中性c(H+)=c(OH-),则c(Na+)=c(CH3COO-),且c(Na+)> c(H+),c(Na+)=c(CH3COO-)>c(OH-)=c(H+)正确,A不符合题意;
B.加入10mLNaOH,与醋酸反应。醋酸恰好消耗一半,得到的溶液为为等物质的量的CH3COOH和CH3COONa的混合溶液。电荷守恒为c(Na+) +c(H+)=c(OH-) +c(CH3COO-),物料守恒为2c(Na+) = c(CH3COO-)+ c(CH3COOH),将两式联合,可以得到2c(H+)+ c(CH3COOH)=2c(OH-) +c(CH3COO-),移项可得2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),B项不符合题意;
C.根据题干信息,AG=![]() ,滴定没有开始时,AG=8.5,而且根据25℃时,溶液中
,滴定没有开始时,AG=8.5,而且根据25℃时,溶液中![]() ,可知开始时c(H+)=10-2.75,
,可知开始时c(H+)=10-2.75,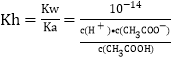 ,可以近似认为c(H+)= c(CH3COO-),c(CH3COOH)基本不变。
,可以近似认为c(H+)= c(CH3COO-),c(CH3COOH)基本不变。 ,不是Kh=10-4.5,C项符合题意;
,不是Kh=10-4.5,C项符合题意;
D.根据题干信息,AG=![]() ,D点AG=-8.5,而且根据25℃时,溶液中
,D点AG=-8.5,而且根据25℃时,溶液中![]() ,可求出c(H+)=10-11.25,D溶液的pH=11.25,D项不符合要求。
,可求出c(H+)=10-11.25,D溶液的pH=11.25,D项不符合要求。
本题答案选C。


科目:高中化学 来源: 题型:
【题目】1,2-丙二醇脱氧脱水反应的催化循环机理如下图所示。

下列说法不正确的是
A. 产物CH2=CHCH3不存在顺反异构
B. 过程②中有O—H键发生断裂
C. 过程③④中均有C—C键发生断裂
D. 该反应方程式为:2CH2(OH)CH(OH)CH3![]() HCHO+CH3CHO+CH2=CHCH3+2H2O
HCHO+CH3CHO+CH2=CHCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒素酯是辣椒的活性成分,有降血压和胆固醇的作用。辣椒素酯类化合物的结构可以表示为 (R为烃基)。图27为一种辣椒素酯J的合成路线:
(R为烃基)。图27为一种辣椒素酯J的合成路线:

回答下列问题:
(1)A的名称是___________,G含有的官能团名称是___________。
(2)F和I生成J的反应类型是___________。
(3)E的结构简式为____________________。
(4)C生成D的化学方程式为_________________________________;H生成I的第①步反应的化学方程式为_________________________________。
(5)G的同分异构体中,苯环上的一氯代物只有一种,且核磁共振氢谱显示2组峰的是___________(写结构简式)。
(6)参照上述路线,设计一条以苯甲醛和乙醇为原料(无机试剂任选)合成肉桂酸
(![]() )的合成路线。___________________
)的合成路线。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
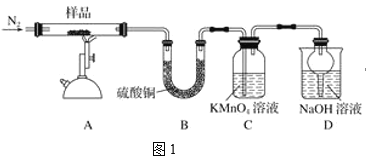

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水。
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在气体______。
(4)实验中要持续通入氮气,否则测出的x会_____(填“偏大”、“偏小”或“不变”)。
(5)从理论上分析得出硫酸亚铁分解还生成另一物质三氧化硫,写出硫酸亚铁分解的化学方程式________。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量分解温度的关系如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g)![]() CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3
(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=___________kJ·mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)下列有关反应①叙述不正确的是___________
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图像:
i说明CO的转化率随温度升高先增大后减小的原因:______________________。
ii.反应②自发进行的条件是______________________。
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=___________。
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___________ν(逆),说明原因_________。
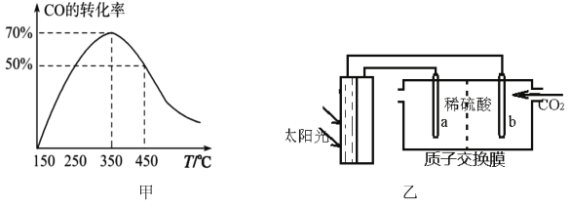
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是实验室常用的部分仪器,请回答下列问题:
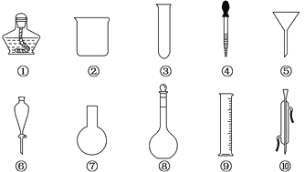
(1)序号为⑧和⑩的仪器的名称分别为______、_______。
(2)在分液操作中,必须用到上述仪器中的__________(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的__________(填名称)。
(4)配制一定物质的量浓度的溶液时要用到的仪器是____________(填序号)。
(5)如图是温度计、量筒、滴定管的一部分,下述读数(虚线对应刻度)及说法正确的是_________。

A.①是量筒,读数为 2.5 mL B.②是量筒,读数为 2.5 mL
C.③是滴定管,读数为 2.5 mL D.②是温度计,读数为 2.5 ℃
(6)除去氧化钙中的碳酸钙可用什么方法?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的C02、N2.电池工作时,下列说法错误的是( )

A. 负极发生的反应为:![]()
B. 正极附近溶液的pH增大
C. 隔膜只允许阳离子通过
D. 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积相同的两个密闭容器中分别充满O2和N2,当这两个容器内温度和气体密度都相等时,下列说法正确的是( )
A. 两种气体的压强相等B. 氧气比氮气的质量大
C. 两种气体的分子数目相等D. 氮气中的含有的原子数多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com