
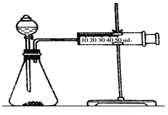
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
分析 实验一:(1)根据表中数据可知,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;
(2)根据图示装置及选取的试剂可知,实验目的是通过测定反应生成氢气快慢进行判断浓度对反应速率的影响;
实验二:利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得,物质的能量越低越稳定.
解答 解:实验一:(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响,
故答案为:探究反应物本身的性质对反应速率的影响;
(2)根据装置图可知,该实验目的是通过测量生成气体的量来研究浓度对反应速率的影响,用大小形状相同的Fe分别和0.5mol/L 及2mol/L的足量稀硫酸反应,通过测定和比较同时间内产生氢气的体积,可以说明浓度对化学反应速率的影响,
故答案为:测定和比较同时间内产生氢气的体积;
实验二:已知:P4(s,白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ•mol-1 ①,
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②,
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1,说明这是一个放热反应,所以相同状况下,白磷比红磷能量高,因为能量越低越稳定,所以红磷比白磷稳定,
故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1; 红磷; 低.
点评 本题探究化学反应速率的影响因素,注意控制变量,外界条件有温度、浓度、压强、催化剂等,外界条件只是影响反应速率,决定化学反应速率的是物质本身的性质,注意盖斯定律的灵活运用,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
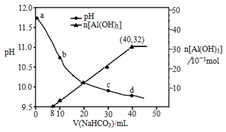 用过量烧碱溶液处理某铝土矿(含Al2O3、Fe2O3),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
用过量烧碱溶液处理某铝土矿(含Al2O3、Fe2O3),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | V(NaHCO3)<8mL时,发生的反应为HCO3-+OH-═CO32-+H2O | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | NaHCO3溶液的物质的量浓度为0.8 mol•L-1 | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3↑+H2O | |
| B. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6 Cl- | |
| D. | 向明矾KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛和丙烯醛( )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| B. | 一分子β-月桂烯(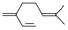 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 | |
| C. | 用甘氨酸(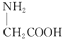 )和丙氨酸( )和丙氨酸(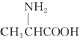 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 | |
| D. | 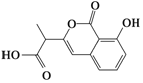 和 和 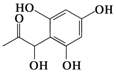 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发 | |
| B. | 蒸馏操作中冷凝管的冷却水应下进上出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 浓硫酸的稀释可以在量筒中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 制备Fe(OH)3胶体时,将饱和FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 | |
| D. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是非金属氧化物 | |
| B. | 都是酸性氧化物,都能与强碱溶液反应 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com