
| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
分析 A、CH4分子中氢最外层只有2个电子;
B、根据离子半径对金属性的影响分析解答碱金属元素单质熔点变化;
C、第ⅦA族元素形成的单质的熔点随原子序数的递增而升高;
D、水中O元素化合价为-2价.
解答 解:A、CH4分子中氢最外层只有2个电子,而不是8电子结构,故A错误;
B、碱金属都为固体,碱金属自上而下,离子半径增大,金属键减弱,熔点降低,故B正确;
C、分子晶体的熔沸点随着相对分子质量的增大而升高,第ⅦA族元素形成的单质为分子晶体,则其单质的熔点随原子序数的递增而升高,故C错误;
D.H2O、Li2O中O元素化合价为-2价,故D错误.
故选B.
点评 本题考查较综合,涉及物质的结构、物质的性质等知识点,根据物质的构成、物质的熔沸点与相对分子质量的关系等知识点来分析解答,比较容易.


科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Al-3e-+3H2O=Al(OH)3+3H+ | |
| B. | 放电过程中,Cl-向正极移动 | |
| C. | 每转移0.2mol电子,理论上生成0.1molH2S气体 | |
| D. | 处理过程中银器一直保持恒重 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
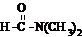 溶于水
溶于水 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的溶解性强于H2S | B. | 氯的最高价为+7价 | ||
| C. | HCl的稳定性强于H2S | D. | HClO的氧化性强于H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 160mL | B. | 200mL | C. | 300mL | D. | 350mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
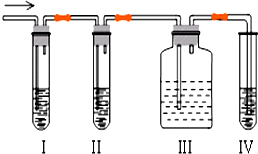 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com