
| A、CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
| B、CH3一CH=CH-CH3和CH3-CH=C-CH3 |
| C、CH3-CH=CH-CH3和CH3-CH2-CH=CH2 |
D、 |
 分子式相同,结构相同,为同种物质,故D错误;
分子式相同,结构相同,为同种物质,故D错误;

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
 (1)A、B、C均为短周期元素,其中A元素的单质是自然界最轻的气体,B元素原子的次外层电子数为最外层电子数和最内层电子数之和,C元素与B元素位于同一主族,且可形成BC2型化合物.
(1)A、B、C均为短周期元素,其中A元素的单质是自然界最轻的气体,B元素原子的次外层电子数为最外层电子数和最内层电子数之和,C元素与B元素位于同一主族,且可形成BC2型化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸与氢氧化钠反应:NaOH+H+=Na++H2O |
| B、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、氯水滴入氯化亚铁溶液中:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用二氧化硫漂白食用银耳 |
| B、在食用盐中添加适量的碘酸钾 |
| C、在食品加工中适量使用食品添加剂 |
| D、研发高效剧毒农药,提高粮食、蔬菜的产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有② | B、②⑤ | C、①④ | D、③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2 L氯气中含有原子数为个NA |
| B、标准状况下,1 mol苯的体积是22.4 L |
| C、1 mol 金属钠作为还原剂可以提供的电子数为NA |
| D、1L 1mol/L硫酸钾溶液中硫酸根和钾离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
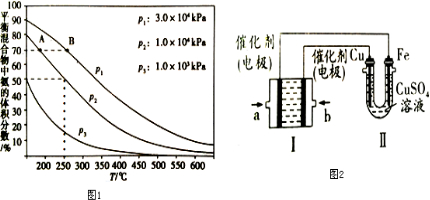
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com