
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.
| ||
| ||
| ||
| ||
| ||
| ||
| 2 |
| 3 |
| 2 |
| 3 |
| ||
| ||
| ||
| ||
| 0.672L |
| 22.4L/mol |
| 0.02 |
| 0.03 |
| 2 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是 。
(2)某实验小组利用右图装置验证铁与水蒸气的反应。
①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是_____(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
① 铁与浓硫酸反应的化学方程式是 。
② 气体中混有CO2的原因是(用化学方程式表示) 。
③ 将672 mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2 + Br2 + 2H2O = 2HBr+ H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是 。
查看答案和解析>>
科目:高中化学 来源:2013届北京市北师特学校高三第二次月考化学试卷(带解析) 题型:填空题
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是 。
(2)某实验小组利用下图装置验证铁与水蒸气的反应。
①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,
固体完全溶解,所得溶液中存在的阳离子是_____ (填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
①铁与浓硫酸反应的化学方程式是 。
②气体中混有CO2的原因是(用化学方程式表示) 。
③将672 mL(标准状况)收集到的气体通入足量溴水中,反应的离子方程式为 ,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市高三第二次月考化学试卷(解析版) 题型:填空题
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是 。
(2)某实验小组利用下图装置验证铁与水蒸气的反应。

①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,
固体完全溶解,所得溶液中存在的阳离子是_____ (填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
① 铁与浓硫酸反应的化学方程式是 。
② 气体中混有CO2的原因是(用化学方程式表示) 。
③ 将672 mL(标准状况)收集到的气体通入足量溴水中,反应的离子方程式为 ,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省高三第一次月考(普)化学试卷(解析版) 题型:填空题
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是 。
(2)某实验小组利用右图装置验证铁与水蒸气的反应。
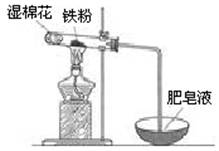
①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是 (填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
① 铁与浓硫酸反应的化学方程式是 。
② 气体中混有CO2的原因是(用化学方程式表示) 。
③ 将672 mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2 + Br2 + 2H2O = 2HBr + H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com