
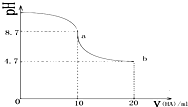
| A. | a点所示溶液中有c(Na+)>c(A-)>c(HA)>c(H+) | |
| B. | a、b两点曲线之间某时刻的溶液中有c(Na+)=c(A-) | |
| C. | a、b两点所示溶液中水的电离程度相同 | |
| D. | b点所示溶液中有 2c(Na+)=c(A-)+c(HA) |
分析 A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,据此进行判断;
B.a、b两点之间在pH=7时,c(H+)=c(OH-),结合电荷守恒判断;
C.b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离;
D.b点HA过量一倍,溶液存在等浓度的NaA和HA,根据物料守恒判断.
解答 解:A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,应为c(Na+)>c(A-)、c(HA)>c(H+),溶液中离子浓度的为:c(Na+)>c(A-)>c(HA)>c(H+),故A正确;
B.pH=7时的点位于a、b之间,此时c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(Na+)=c(A-),故B正确;
C.a点A-水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离,故C错误;
D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(HA),故D正确;
故选C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能发生反应 | |
| C. | 反应物和生成物所具有的总能量决定了放热还是吸热 | |
| D. | 吸热反应只能在加热的条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
某气体的摩尔质量为Mg/mol,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则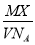 表示的是
表示的是
A、VL该气体的质量(以g为单位)
B、1L该气体的质量(以g为单位)
C、1mol该气体的体积(以L为单位)
D、1L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
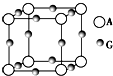 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
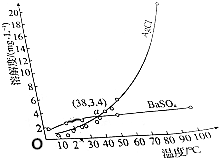
| A. | a点时,AgCl和BaSO4饱和溶液的密度基本相同 | |
| B. | AgCl的溶解是吸热过程 | |
| C. | 室温时,向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,析出BaSO4沉淀的质量比AgCl多 | |
| D. | 可以用重结晶的方法分离AgCl和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯无同分异构体 | |
| B. | 邻二甲苯只有一种 | |
| C. | 苯分子中各原子均在一个平面内,各键键角均为120° | |
| D. | 1mol苯最多只能与3mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| C. | 用NaOH溶液滴定醋酸溶液时,不宜选用甲基橙作指示剂 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com