

| A.NaClO | B.H2O2 | C.KMnO4 | D.Cl2 |
 c(H+)=Kw÷c(OH-)=10-14÷10-9=10-5;所以pH=5。
c(H+)=Kw÷c(OH-)=10-14÷10-9=10-5;所以pH=5。

科目:高中化学 来源:不详 题型:单选题
| A.氢氟酸具有强酸性,可用于雕刻玻璃 |
| B.氨气显碱性,可用P2O5或无水CaCl2干燥 |
| C.MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
| D.铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.5 mol/L | B.3.0 mol/L |
| C.2.0 mol/L | D.1.0 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
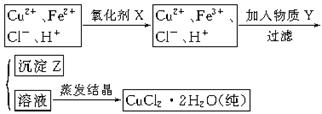
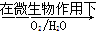 Fe2++SO42-
Fe2++SO42-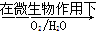 Fe3+
Fe3+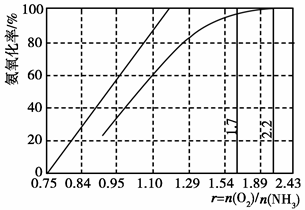
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
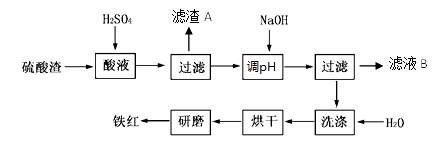
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
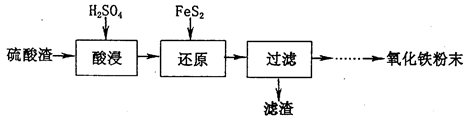
 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
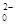 +Hg2Cl2↓
+Hg2Cl2↓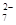 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com