
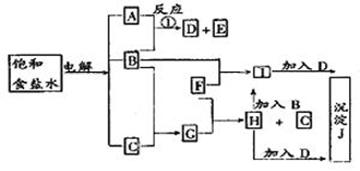
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ 2HCl
2HCl 2FeCl3
2FeCl3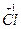 );又是强碱(NaOH)弱酸(HClO)盐,在水中水解而显碱性。因此当它与FeCl3反应时显示了碱性从而生成 Fe(OH)3,(J)沉淀;当它与 FeCl2反应时显示了氧化性和碱性的双重作用,也生成了Fe(OH)3(J)沉淀。这样确认J是 Fe(OH)3。
);又是强碱(NaOH)弱酸(HClO)盐,在水中水解而显碱性。因此当它与FeCl3反应时显示了碱性从而生成 Fe(OH)3,(J)沉淀;当它与 FeCl2反应时显示了氧化性和碱性的双重作用,也生成了Fe(OH)3(J)沉淀。这样确认J是 Fe(OH)3。

科目:高中化学 来源:不详 题型:单选题
| A.裂纹处尘埃多,起催化作用? |
| B.裂纹里面含水分? |
| C.裂纹处铁的表面积大,反应快? |
| D.原裂纹处的Fe2O3与盐酸反应,生成可溶的FeCl3? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
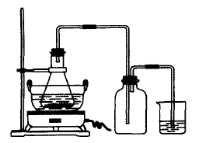
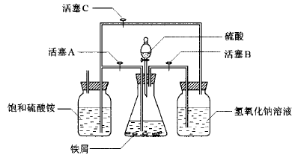
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克? (2)加入铁粉前Fe2(SO4)3物质的量浓度。
(2)加入铁粉前Fe2(SO4)3物质的量浓度。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2SO4的物质的量之比为 ( )
H2SO4的物质的量之比为 ( )
| A.1 :7 | B.7 :1 | C.7 :8 | D.8 :7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
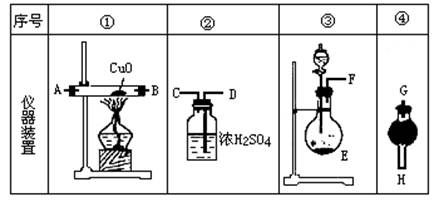
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com