
����Ŀ��������������Խ������Ϊ��������֮�����������������������(��Ҫ�ɷ�ΪFeTiO3��������Fe2O3��SiO2������)�������Ʊ�TiO2��ͬʱ�õ�����Ʒ�̷�(FeSO4��7H2O)������������ͼ��ʾ��
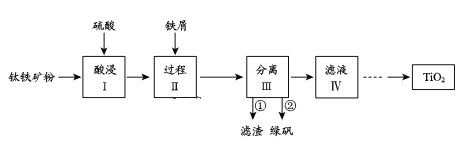
��֪����FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
��TiO2+��ˮ�⣬ֻ�ܴ�����ǿ������Һ��
��1�����I��Fe2O3��ϡ���ᷴӦ�����ӷ���ʽ��_____��
��2������II�м���������м��Ŀ����____��
��3������III�в���ڵõ��̷��IJ�����_____��
��4������ҺIV��ȡTiO2�Ĺ������£�
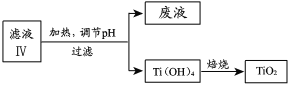
�����û�ѧƽ���ƶ�ԭ��������Һ������е�Ŀ�ģ�______��
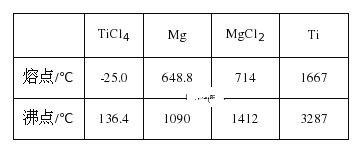
����2Mg+TiCl4��Ti+2MgCl2��Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�����������Ϣ������ȵ��¶��Ը���___�漴�ɡ�
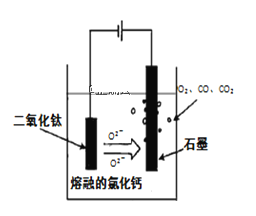
�۵��TiO2�Ʊ��ѵķ�����ͼ��ʾ���÷������ھ߱��������̼������ɱ��͡���Ʒ�����ߡ������Ѻõ�����ŵ������עĿ����֪TiO2����״̬�²��������룬���ʱ������ӦʽΪ____��
���𰸡�Fe2O3+6H+= 2Fe3++3H2O ��Fe3+��ԭΪFe2+ ����Ũ������ȴ�ᾧ������ �÷�ӦΪ���ȷ�Ӧ���¶�����ƽ�������ƶ�������������Ti(OH)4 1412 TiO2+4e-=Ti+2O2-
��������
��������Ҫ�ɷ�ΪFeTiO3��������Fe2O3��SiO2�����ʣ��������ᴦ�����õ�ǿ������Һ�к���TiOSO4��FeSO4��δ��Ӧ������ȣ���������Ŀ���ǽ�Fe3+ת��ΪFe2+����ֹFe3+��TiO2+ͬʱ���ɳ�������Һ����Ҫ����Fe2+��TiO2+���������������Ũ������ȴ�ᾧ�����˵õ��̷�����Һ������Һ���к���TiOSO4���ɵ���pH����TiO��OH��2�����������ȷֽ�����TiO2���Դ˽����⡣
��1����� I��Fe2O3��ϡ���ᷴӦ�����ӷ���ʽΪFe2O3+6H+�T2Fe3++3H2O��
�ʴ�Ϊ��Fe2O3+6H+�T2Fe3++3H2O��
��2�������Ϸ�����֪���� II�м���������м��Ŀ���ǽ�Fe3+��ԭΪFe2+��
�ʴ�Ϊ����Fe3+��ԭΪFe2+��
��3������Һ�õ��̷����壬Ӧ���м���Ũ������ȴ�ᾧ�����ˣ��ʴ�Ϊ������Ũ������ȴ�ᾧ�����ˣ�
��4������Һ���к���TiOSO4��ˮ������ԣ�����TiO2++3H2OTi��OH��4+2H+��ˮ�ⷴӦΪ���ȹ����¶�����ƽ�������ƶ�������������Ti��OH��4��
�ʴ�Ϊ���÷�ӦΪ���ȷ�Ӧ���¶�����ƽ�������ƶ�������������Ti��OH��4��
����O2-�����ƶ������֪ͨ��������һ��Ϊ����������������Ӧ����ˮ���缫����ʽΪH2-2e-+O2-�TH2O��
�ʴ�Ϊ��H2-2e-+O2-�TH2O��
���ɱ����е����ݿɵã�Ti���۵����Mg��MgCl2�����¶ȸ���1412�棬Mg��MgCl2���γ���������ʽ����������ѷ��룻
����1412��
�۵��ʱ����������ԭ��Ӧ����ΪTiO2����״̬�²��������룬������TiO2�õ�������Ti���ʺ�O2���缫��ӦʽΪTiO2+4e=Ti+2O2��
�ʴ�Ϊ��TiO2+4e=Ti+2O2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2A��g��B��g�����ֱ�ȡ1molA��2L�Ĺ̶�����������У��ֱ���T1��T2�£����A��ת������ʱ��仯�Ĺ�ϵ������ͼ��ʾ������˵����ȷ����

A.�����¶ȿ����̷�Ӧ����ƽ���ʱ��ͬʱ�����Aƽ���ת����
B.�ӷ�Ӧ��ʼ��40minʱ��T2�¶�������B�����ʵ�����T1�¶��¶�
C.ͼ��a��b��c����Ļ�ѧ��Ӧ�������μ�С
D.��B��ʾT1�¶���ǰ40min��ƽ����Ӧ���ʣ�v(B)��0.0025molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��R��X��Y ��Z��ԭ������������������M��N����������Ԫ����ɣ���M����Է���������NС16���ֱ���M��N�м����ռ�Ũ��Һ�����ȣ����߾��ɲ���ʹʪ��ĺ�ɫʯ����ֽ���������塣����˵���������
A.X �γɵ�ij������X5+��ÿ��X���ﵽ8���ӽṹ
B.M��N���ܷ�����Ӧ
C.R��Y�γɵľ���Ư���Ե����ʺ�Y��Z�γɵľ���Ư���Ե����ʵ����ʵ�����Ϻ�Ư������ǿ
D.X��Z�������̬�⻯��֮�䷴Ӧ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�ˮ������������Ӧ���������ܵ���Ч����֮һ��
(1)�״�ˮ������������������¸���Ӧ��(��֪a��b��������)
�״��ֽ� ��CH3OH(g) CO(g)+2H2(g) ��H= +akJ��mol-1
��ˮ�����任��CO(g)+H2O(g)CO2(g)+ H2(g) ��H= ![]() kJ��mol-1
kJ��mol-1
��������Ӧ��CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) ��H=________kJ��mol-1
(2)�״��ֽ���ˮ�����任��ӦKp���¶ȹ�ϵ���±���
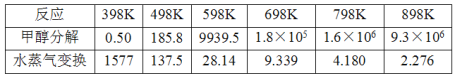
��698Kʱ��CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)��Kp=___________��(����С������λ)
���ڽϸ��¶��½��и÷�Ӧ������ƽ��ʱ��ϵ��CO����ƫ�ߵ�ԭ����_____________��
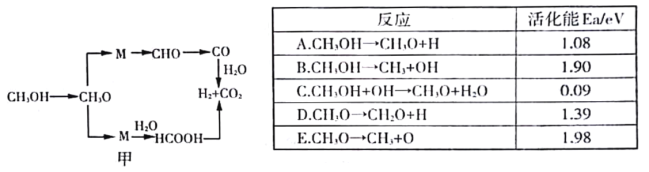
(3)�״�ˮ����������Ӧ�Ŀ��ܻ�����ͼ����ʾ������±�����CH3OH ��CH3O����Ҫ��ӦΪ______________(�����)������ԭ��______________________________________________________________��
(4)ij�о�С���������Ӧ�¶�(T)��ˮ����(![]() )�����Ż����õ�ͼ�ҡ�����
)�����Ż����õ�ͼ�ҡ�����
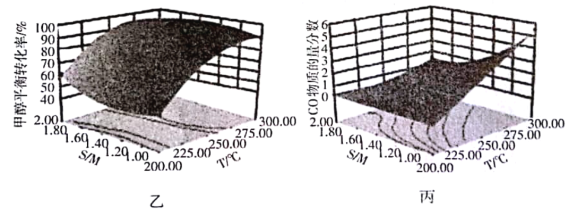
���ͼ�ҷ����¶ȡ�ˮ������״�ƽ��ת���ʵĹ�ϵ��________________.
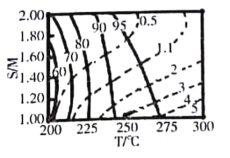
����ͼ������Ӱ�������Ż��ķ�Ӧ��������(��ͼΪ�Һͱ���ϵ�ƽ��ͼ��ʵ��Ϊ�״�ƽ��ת���ʣ�����ΪCO���ʵ�������)��______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾��Τ��һ�ָ�Ч����ѡ��������ø���Ƽ�����Ŀǰ�������е����ҩ��֮һ���ǹ��ϵĿ������С�����H1N1�Ȳ�������Ч��ҩ��֮һ�� Ҳ�ǹ��ҵ�ս�Դ���ҩ�Ҳ��ר�ҳ���ʹ�ð�˾��Τ��Ϊ�����ֹ�״��������ҩ���˾��Τ�ĺϳ�·�����£�
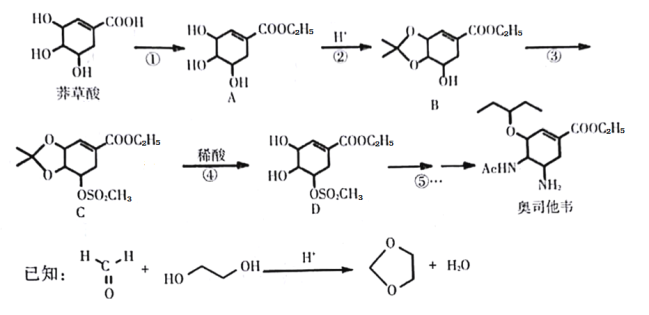
�ش��������⣺
(1)ç����ĺ�������������Ϊ��___________
��Ӧ�۵ķ�Ӧ���ͣ�__________________��
(2)��Ӧ�ٵķ�Ӧ�Լ��ͷ�Ӧ������________________________________��
(3)��д����Ӧ�ڵĻ�ѧ����ʽ��__________________________________��
(4)���㻯����X��B��ͬ���칹�壬����Ϲ�����ֻ�����ǻ���X��_____�֡�
(5)̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼��Ϊ����̼��C����_____������̼��
(6)����ɶԼ�����ȩ![]() �Ʊ���ȩ��������
�Ʊ���ȩ��������![]() �ĺϳ�·������ͼ��ʾ��
�ĺϳ�·������ͼ��ʾ��
![]()
![]() M
M![]()
![]()
![]()
д��M�ṹ��ʽ__________________������1Ϊ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ɳ���Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ���������ʾ�йص�һ�ַ�Ӧ�����������������Ѿ���ȥ��������A��B��D�ڳ����¾�Ϊ��ɫ��ζ�����壬C����ʹʪ��ĺ�ɫʯ����ֽ���������壬M���������ɫҺ�塣

��1��д��C��E�Ļ�ѧ����ʽ�� ��
��2��ʵ���ҳ��ü������ֹ�������ķ����Ʊ�����C���仯ѧ����ʽΪ�� ������C���� ����д�Լ����ƣ���
��3��E��������D����ʱ����۲쵽 ����������ˮ���ռ�F�������ռ���ƿ���ռ���������Ϊ ����д���ʵĻ�ѧʽ����
��4��д��A��D�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A��B������ס��ҡ���������C��D��E��F��G������֮���ܷ�����ͼ��Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������

�����������Ϣ�ش��������⣺
(1)д���������ʵĻ�ѧʽ����_________��F__________��
(2)д�����з�Ӧ�����ӷ���ʽ��
�ٽ���A��ˮ��Ӧ_______________���ں��ɫ����C������E��Ӧ__________��
��F�����ɫ�����ҷ�Ӧ____________��
��ʵ���ҳ���������������ʵ������еĻ���ɫ�����ң�д��������������Һ���ո���������ӷ���ʽ___��
(3)��G��Һ��μ��뵽��ˮ�л����һ�ֺ��ɫ��Һ�塣����Ϊ��Һ���еķ�ɢ������ֱ����______֮�䣬��֤�ļ����ǣ�_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�á�

��1��д������ʵ������������A___��B___��C__��D___��
��2����װ��1�������Ȼ�̼��Br2�Ļ���ʵ�����������Ϊ___�������ܵĽ�ˮ����___������a��b����
��3����������480mL 0.2mol/L KOH��Һ����Ҫ����KOH___g�����ƹ��������õ���������������ƽ���ձ���___��___����ͷ�ιܡ�
��4��װ��2��ijͬѧת����Һ��ʾ��ͼ��ͼ�еĴ�����___��
��5�����в���������Ũ��ƫ�ߵ���___��
A.��Һδ��ȴ�����¾�ת��������ƿ�� B.��������ʱ���ұ߷�ҩƷ����߷�����
C.����ʱ���Ӷ��� D.����ƿ�е�ˮδ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ����ͭ���壨CuSO4xH2O����xֵ��ʵ��������£�

���������գ�
��1������Ҫ���к��ز�����ԭ����___��
��2��������ijͬѧ��һ��ʵ���¼��������±���
��������1 | ��������2 | ��������3 | �ᾧˮ��Xֵ | ʵ����� |
11.685g | 13.691g | 12.960g | ____ | ____ |
��3������ʵ����Xֵƫ__���ߡ��ͣ����������ʵ���в�������ԭ�������___��
A������ͭ�����к��в��ӷ������� B��ʵ��ǰ���������ʪ��ˮ
C������ʱ�о���ɽ���ȥ D������ʧˮ��¶���ڿ�������ȴ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com