
【题目】NaCl是一种基础化工原料,通过电解饱和食盐水可以制得NaOH、H2、Cl2。
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________________。
(2)氯原子的最外层电子排布式为_______,氯离子核外有_____种运动状态不同的电子。
(3)氯气压缩成为液氯属于________变化(选填“物理”“化学”)。常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目__________________。
(4)氯气可用来标定碘水中碘单质的含量:5Cl2+I2+6H2O→10HCl+2HIO3。测定时可用气体流量计准确控制氯气的体积,以淀粉做指示剂来指示反应终点,反应终点时的现象是___________________。
用氯气标定一定体积碘水中碘单质的浓度,进行三次平行实验,数据记录见下表:
碘水的体积(mL) | 标况下氯气的体积(mL) |
500 | 56 |
500 | 55 |
500 | 57 |
则上述碘水中碘单质的浓度为____mol/L,假定碘水的实际浓度为1.02×10-3mol/L,则实验的相对误差为_______(保留两位小数)。
【答案】 2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑ 3s23p5 18 物理
2NaOH + H2↑ + Cl2↑ 3s23p5 18 物理 ![]() 溶液由蓝色逐渐变为无色,且在半分钟内不变色 1 × 10-3 mol/L -1.96%
溶液由蓝色逐渐变为无色,且在半分钟内不变色 1 × 10-3 mol/L -1.96%
【解析】(1)电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的化学方程式为2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑,故答案为:2NaCl + 2H2O
2NaOH + H2↑ + Cl2↑,故答案为:2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑;
2NaOH + H2↑ + Cl2↑;
(2)氯是17号元素,原子的最外层电子排布式为3s23p5,氯离子核外有18种运动状态不同的电子,故答案为:3s23p5;18;
(3)氯气压缩成为液氯是状态的变化,属于物理变化;浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体为氮气,反应的化学方程式和电子转移的方向和数目表示为![]() ,故答案为:物理;
,故答案为:物理;![]() ;
;
(4)根据5Cl2 + I2 + 6H2O → 10HCl + 2HIO3,以淀粉做指示剂来指示反应终点,反应终点时溶液由蓝色逐渐变为无色,且在半分钟内不变色;三次的平均体积为56 mL,根据5Cl2 + I2 + 6H2O → 10HCl + 2HIO3,n(I2)= ![]() n(Cl2)=
n(Cl2)= ![]() ×
×![]() =5×10-4mol,c(I2)=
=5×10-4mol,c(I2)= ![]() = 1 × 10-3 mol/L,实验的相对误差=
= 1 × 10-3 mol/L,实验的相对误差=![]() ×100%= -1.96%,故答案为:溶液由蓝色逐渐变为无色,且在半分钟内不变色;1 × 10-3 mol/L; -1.96%。
×100%= -1.96%,故答案为:溶液由蓝色逐渐变为无色,且在半分钟内不变色;1 × 10-3 mol/L; -1.96%。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,Zn(OH)2能溶于NaOH溶液。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)实验中的过滤操作所用到的玻璃仪器为____________________。
(2)加入ZnO调节pH=a的目的是____________________,a的范围是___________。
(3)由不溶物E生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是___________,__________,过滤。
(5)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________。
(6)若废旧黄铜的质量为a g,最终得到的胆矾晶体为b g,则该黄铜中铜元素的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,对形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为____________。
(2)上述元素最高价氧化物对应的水化物酸性最强的是_______(写化学式),非金属气态氢化物还原性最强的是___________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写出其中两种物质的化学式)。
(4)ZX的电子式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三气体种物质的物质的量随时间的变化曲线如图所示,据此回答:

(1)该反应的化学方程式为___________
(2)从开始至2min,X的平均反应速率为________mol/(L·min)
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.增加物质Z的物质的量. D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的工业制法中,不正确的是:
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁
C. 制铁:以铁矿石为原料,CO还原得铁
D. 制漂白粉:将氯气通入石灰乳中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、Mg2+、NO3-、Cl- B. Ba2+、Na+、CO32-、 OH-
C. Mg2+、Ba2+、OH-、NO3- D. H+、 K+、 CO32-、 SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机化合物之间具有如下转化关系:
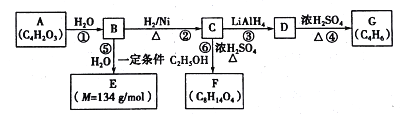
其中A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种化学环境的氢原子,且峰面积之比为2:2:3。
已知:①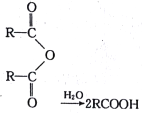 (其中R是烃基)
(其中R是烃基)
②R-COOH![]() R-CH2OH(其中R是烃基)
R-CH2OH(其中R是烃基)
请回答下列问题:
(1)B中含氧官能团的名称是______,G是合成顺丁橡胶的主要原料,G的名称是_____,③的反应类型是________。
(2)写出A的结构筒式____________。
(3)写出⑥的化学方程式__________________。
(4)E在一定条件下能够发生缩聚反应,其中主链上含“-CH2-”的聚物的结构简式为_____。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com