
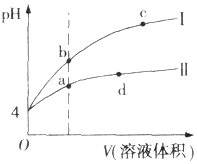
 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
分析 A、pH=4的HCl溶液中氢氧根离子由水电离产生,而水电离出的氢离子与氢氧根离子的物质的量相等;
B、HCl和CH3COOH溶液加水稀释相同的倍数,而醋酸在不断的电离产生氢离子,所以盐酸的PH值变化大;
C、a、d点溶液是溶液的体积不同,但溶质的物质的量相同;
D、Kw是温度的函数,温度相同Kw值相同.
解答 解:A、pH=4的HCl溶液中氢氧根离子由水电离产生,而水电离出的氢离子与氢氧根离子的物质的量相等,溶液中氢氧根的离子的浓度为10-10mol/L,所以H2O电离出的c(H+)=10-10 mol.L-1,故A错误;
B、HCl和CH3COOH溶液加水稀释相同的倍数,而醋酸在不断的电离产生氢离子,所以盐酸的PH值变化大,而变化大的是曲线Ⅰ,则曲线I为HCl溶液的稀释曲线,故B错误;
C、a、d点溶液是溶液的体积不同,但溶质的物质的量相同,所以a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等,故C正确;
D、Kw是温度的函数,温度相同Kw值相同,所以a、b、c三点溶液中Kw:c=b=a,故D错误;
故选C.
点评 本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点,题目难度不大,侧重于基础知识的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一物质的固、液、气三种状态的熵值相同 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g);△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  | 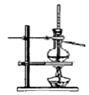 | 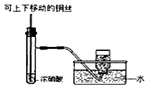 |
| A.制备少量氨气 | B.吸收HCl | C.分离苯和乙醇的混合物 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量始终小于92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| D. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,33.6L三氧化硫中含有硫原子的数目为1.5 NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
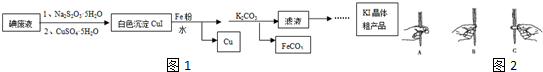
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com