
| A. | O | B. | N | C. | Cu | D. | F |
分析 A、O的核外电子排布式为1s22s22p4;
B、N的核外电子排布式为1s22s22p3;
C、Cu的核外电子排布式为1s22s22p63s23p63d104s1;
D、Cu的核外电子排布式为1s2 2s22p5;
据此分析解答.
解答 解:A、O的核外电子排布式为1s2 2s22p4,p能级包括3个原子轨道,因此未成对电子数为2,故A正确;
B、N的核外电子排布式为1s22s22p3,p能级包括3个原子轨道,因此未成对电子数为3,故B错误;
C、Cu的核外电子排布式为1s22s22p63s23p63d104s1,s能级包括1个原子轨道,因此未成对电子数为1,故C错误;
D、F的核外电子排布式为1s2 2s22p5,p能级包括3个原子轨道,因此未成对电子数为1,故D错误;
故选:A.
点评 本题考查原子核外电子的排布,题目难度中等,注意根据电子排布式判断未成对电子数.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn+>D(n+)->An+>B(n+)+ | D. | 单质还原性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
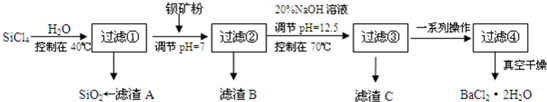
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com