
分析 (1)2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0)中的a表示2molA2完全反应时放出akJ热量,因为该反应是可逆反应,加入2molA2时,A2反应的物质的量小于2mol;
(2)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;该反应的正反应是放热反应,升高温度平衡逆向移动;
(3)相同条件下,2mol C3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC3,放出热量为c kJ;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量都不变,以及由此引起的一系列物理量不变;
(5)增大反应速率且平衡正向移动,可以通过增大反应物浓度、增大压强实现;
(6)保持温度不变,按下列比例充入固定容积的容器中,达到平衡后C的浓度仍为w mol/L,说明与原来平衡为等效平衡,只要进入的物质完全转化为反应物时应该相当于是2molA2、1molB2;
(7)若将上述容器改为恒压容器(反应前体积相同),与原容器相比相当于增大压强,增大压强平衡正向移动;
(8)①A(g)+2B(g)?C(g)+D(g),
开始(mol)1.0 2.2 0 0
反应(mol)0.6 1.2 0.6 0.6
平衡(mol)0.4 1 0.6 0.6
平衡时c(A)=0.4mol/L、c(B)=1.0mol/L、c(C)=c(D)=0.6mol/L,
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$,升高温度平衡向吸热方向移动;
②先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向.
解答 解:(1)2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0)中的a表示2molA2完全反应时放出akJ热量,因为该反应是可逆反应,加入2molA2时,A2反应的物质的量小于2mol,所以放出的热量a>b,
故答案为:>;
(2)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,该反应平衡常数表达式K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2}).c({B}_{2})}$;该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,
故答案为:K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2}).c({B}_{2})}$;减小;
(3)相同条件下,2mol C达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,则b+c=a,
故答案为:b+c=a;
(4)a.v(C)=2v(B2)时,反应速率方向未知,无法判断是否达到平衡状态,故错误;
b.反应前后气体的压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故正确;
c.v逆(A2)=2v正(B2)=v正(A2),正逆反应速率相等反应达到平衡状态,故正确;
d.无论反应是否达到平衡状态,容器内的气体密度始终保持不变,不能据此判断平衡状态,故错误;
故选bc;
(5)a、及时分离出C气体,平衡正向移动,但反应速率减小,故错误;
b、适当升高温度,平衡逆向移动,故错误;
c、增大B2的浓度,平衡正向移动且反应速率增大,故正确;
d、选择高效的催化剂,反应速率增大但平衡不移动,故错误;
故选c;
(6)保持温度不变,按下列比例充入固定容积的容器中,达到平衡后C的浓度仍为w mol/L,说明与原来平衡为等效平衡,只要进入的物质完全转化为反应物时应该相当于是2molA2、1molB2,
可以是充入2molC、充入1.2molA+0.6molB+0.8molC或1molA+0.5molB+1molC,
故答案为:②④⑤;
(7)若将上述容器改为恒压容器(反应前体积相同),与原容器相比相当于增大压强,增大压强平衡正向移动,放出的热量大于d>b,
故答案为:>;
(8)①A(g)+2B(g)?C(g)+D(g),
开始(mol)1.0 2.2 0 0
反应(mol)0.6 1.2 0.6 0.6
平衡(mol)0.4 1 0.6 0.6
平衡时c(A)=0.4mol/L、c(B)=1.0mol/L、c(C)=c(D)=0.6mol/L,
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$=$\frac{0.6×0.6}{0.4×1.{0}^{2}}$=0.9,
升高温度平衡向吸热方向移动,升高温度D的物质的量增大平衡正向移动,所以该反应的正反应是吸热反应,
故答案为:0.9;吸热;
②该时刻浓度商=$\frac{0.20×0.018}{0.06×(0.50)^{2}}$=0.24<0.9,平衡正向移动,
故答案为:向正方向进行.
点评 本题考查化学平衡计算,为高频考点,涉及浓度商与化学平衡常数计算、等效平衡计算、化学平衡状态判断等知识点,侧重考查学生分析计算能力,难点是等效平衡的建立,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C3H4 | C. | C3H8 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
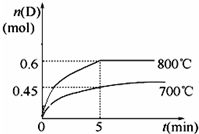
 氨气是重要的化工原料.
氨气是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
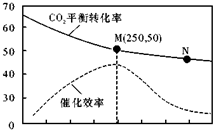 一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)>v(N) | |
| B. | 平衡常数KM<KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com