
分析 设CO和CO2的物质的量分别为x、y,结合质量关系、物质的量关系计算,由此分析解答.
解答 解:设CO和CO2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{28x+44y=14.4g}\\{x+y=\frac{8.96L}{22.4L/mol}}\end{array}\right.$,解得x=0.2mol、y=0.2mol,
CO的质量为0.2mol×28g/mol=5.6g,CO2的物质的量为0.2mol,体积为:4.48L,碳与氧两种原子的数目之比为(0.2+0.2):(0.2+0.2×2)=2:3;混合气体的平均摩尔质量为$\frac{14.4}{\frac{8.96}{22.4}}$=36g•mol-1,
故答案为:①5.6;②4.48; ③2:3; ④36.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量就是物质的相对分子质量 | B. | 摩尔质量就1mol物质所具有的质量 | ||
| C. | HNO3的摩尔质量是63g | D. | 硫酸和磷酸的摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )
据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )| A. | 电池放电时 Na+从 b 极区移向 a 极区 | |
| B. | 每消耗 3mol H2O2,转移的电子为3mol | |
| C. | 电极 a 采用 MnO2,MnO2 既作电极材料又有催化作用 | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | Al2H6中铝的杂化方式为sp3杂化 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为三氧化二铝和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的总分子数不再变化 | B. | 混合气体的颜色不再变化 | ||
| C. | 容器的总压强不再变化 | D. | 混合气体的总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
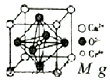 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: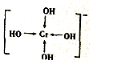 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂降低反应的活化能来提高化学反应效率 | |
| B. | 油脂和纤维素都属于高分子化合物 | |
| C. | 神州飞船的防护层中含聚四氯乙烯,合成它的单体属于卤代烃 | |
| D. | 中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
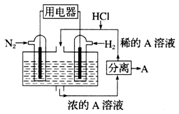 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com