(1)标准状况下,44.8L的NH3气体质量为______g,其中含______个氮原子,其中含______mol 氢原子.
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是______,等质量的NH3与H2R的物质的量比为______,1.7g氨气与______mol H2O含有的电子数相等.
(3)过氧化钠几乎可与所有的常见气态非金属氧化物反应.如:2Na2O2+2CO2=2Na2CO3+O2; Na2O2+CO=Na2CO3试分别写出Na2O2与SO2、SO3反应的化学方程式:______
(4)取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,观察实验现象并写出相关的化学方程式:
①实验现象______
②有关的化学方程式是______.
解:(1)标准状况下,44.8L的NH
3气体质量=
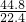
×17g/mol=34g,其中含氮原子数═
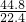
N
A=2N
A(1.204×10
24),氢原子的物质的量是6mol,
故答案为:34;2N
A(1.204×10
24);6;
(2)标准状况下,11.2L的H
2R气体的物质的量是0.5mol,质量为17g,则H
2R的摩尔质量是
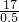
=34(g?mol
-1),根据公式n=

,等质量的NH
3与H
2R的物质的量比等于其相对分子质量的倒数比,即2:1,1.7g氨气即0.1mol氨气中含有1mol电子,1mol水中含有1mol电子,所以和0.1mol H
2O含有的电子数相等,
故答案为:34g?mol
-1;2:1;0.1;
(3)过氧化钠可以和酸性氧化物发生反应生成盐和氧气,但是亚硫酸盐易被氧气氧化为硫酸盐,Na
2O
2与SO
2、SO
3反应的化学方程式:2Na
2O
2+2SO
3=2Na
2SO
4+O
2Na
2O
2+SO
2=Na
2SO
4,故答案为:2Na
2O
2+2SO
3=2Na
2SO
4+O
2、Na
2O
2+SO
2=Na
2SO
4;
(4)①金属钠和盐之间发生反应的规律:先和水反应,然后是生成的氢氧化钠和盐之间的复分解反应,现象是:钠浮在液面上,熔成一个闪亮的小球,四处游动并发出响声;溶液中生成蓝色絮状沉淀,故答案为:钠浮在液面上,熔成一个闪亮的小球,四处游动并发出响声;溶液中生成蓝色絮状沉淀;
②金属钠和盐之间发生反应的规律:先和水反应,然后是生成的氢氧化钠和盐之间的复分解反应,即2Na+2H
2O=2NaOH+H
2↑,CuSO
4+2NaOH=Cu(OH)
2↓+Na
2SO
4,
故答案为:2Na+2H
2O=2NaOH+H
2↑,CuSO
4+2NaOH=Cu(OH)
2↓+Na
2SO
4.
分析:(1)根据公式N=nN
A=
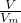
N
A来计算;
(2)摩尔质量在数值上等于其相对分子质量,根据公式n=

来计算物质的量,进而计算比值;
(3)过氧化钠可以和酸性氧化物发生反应生成盐和氧气,但是亚硫酸盐易被氧气氧化为硫酸盐;
(4)根据金属钠和水发生反应的现象以及金属钠和盐之间发生反应的规律:先和水反应,然后是生成的氢氧化钠和盐之间的复分解反应来回答.
点评:本题考查学生金属钠的化学性质以及有关物质的量的计算等方面的知识,可以根据所学知识来回答,难度不大.

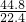 ×17g/mol=34g,其中含氮原子数═
×17g/mol=34g,其中含氮原子数═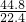 NA=2NA(1.204×1024),氢原子的物质的量是6mol,
NA=2NA(1.204×1024),氢原子的物质的量是6mol,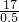 =34(g?mol-1),根据公式n=
=34(g?mol-1),根据公式n= ,等质量的NH3与H2R的物质的量比等于其相对分子质量的倒数比,即2:1,1.7g氨气即0.1mol氨气中含有1mol电子,1mol水中含有1mol电子,所以和0.1mol H2O含有的电子数相等,
,等质量的NH3与H2R的物质的量比等于其相对分子质量的倒数比,即2:1,1.7g氨气即0.1mol氨气中含有1mol电子,1mol水中含有1mol电子,所以和0.1mol H2O含有的电子数相等,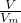 NA来计算;
NA来计算; 来计算物质的量,进而计算比值;
来计算物质的量,进而计算比值;
