
【题目】25℃时,体积均为25.00mL,浓度均为0.0100mo1L-1的HA、H3B溶液分别用0.0100mo1L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )
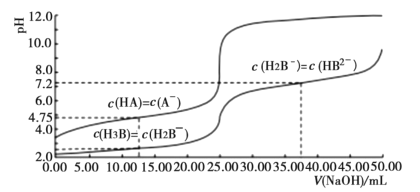
A.25℃时,0.0100mo1L-1Na2HB溶液的pH>7
B.向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C.NaOH溶液滴定HA溶液应选甲基橙作指示剂
D.25℃时,H2B-离子的水解常数的数量级为10-3
【答案】A
【解析】
A. 25℃时,0.0100mo1L-1Na2HB溶液,根据c(H2B-)=c(HB2-)时,溶液显碱性,可知HB2-水解程度大于电离程度,溶液pH>7,A正确;
B. 根据c(HA)=c(A-)时,溶液显酸性,可知A-水解程度小于HA电离程度,继续加入氢氧化钠,HA浓度减小,到达中性时,c(A-)>c(HA),B错误;
C. NaOH溶液滴定HA溶液时,滴定突跃pH在6.0到8.0之间,甲基橙在pH大于4.4时即为黄色,不能作指示剂,应用酚酞做指示剂,C错误;
D. 25℃时,根据c(H2B-)=c(H3B)时,pH=2.0,H2B-离子的水解常数K=![]() ,数量级为10-12,D错误;
,数量级为10-12,D错误;
答案为A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(用NA表示阿伏加德罗常数的值)
A. 17g羟基(-OH)所含有的电子数是10 NA个
B. 常温下,14g乙烯含有的共用电子对数是2.5NA个
C. 12 g石墨中含有C﹣C键的个数为1.5NA
D. 标准状况下,CH4发生取代反应生成22.4LCH2Cl2,需要消耗2NA个Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
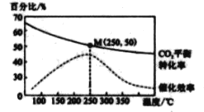
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( )
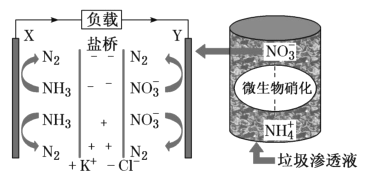
A.盐桥中K+向X极移动
B.电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L
C.该装置实现了将电能转化为化学能
D.Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH-,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图甲所示装置电解饱和食盐水制Cl2、H2和NaOH。

(1)b为电源的______极,Cu极的电极反应式为________。
(2)某同学在进行上述实验时,发现铜电极下方产生红色沉淀,石墨电极上产生无色无味的气体,则该同学将石墨连接到了电源的______极。
(3)电解粗铜制精铜时,可采用NO2、O2和熔融NaNO3制作的燃料电池作电源,其原理如图,该电池在使用过程中石墨 I电极上生成氧化物Y,则其正极的电极反应为:__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式__。第三电离能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是__。
②O3分子的中心原子杂化类型为___;与O3互为等电子体的是__(任意写一种)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dgcm3。
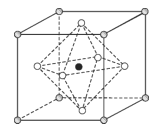
①Na3OCl晶胞中,O位于各顶点位置,Cl位于__位置。
②用a、d表示阿伏加德罗常数的值NA=__(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验某溶液中是否含有SO![]() 的方法中正确的是( )
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO![]()
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素及其化合物在生产生活中至关重要。
(1)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中含有的化学键包括____________________。
(2) NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是___________。
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有阴阳离子各一种,结构是正四面体型离子和正八面体型离子;正八面体型离子的化学式为_________________________;正四面体型离子中键角大于PCl3的键角原因为______________________________________________________。
(4)氯化钠的晶胞结构如图所示,图是氯化钠的晶胞截面图(图中球大小代表半径大小)。已知NA代表阿伏加德罗常数的值,氯化钠晶体的密度为d g·cm-3。则Na+半径为____________pm(只需列出计算式)。

(5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B: (0,0,0); (![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() );……
);……
As:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );……
);……
①请在图中画出砷化硼晶胞的俯视图______。
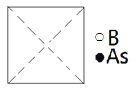
②砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有______个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com