
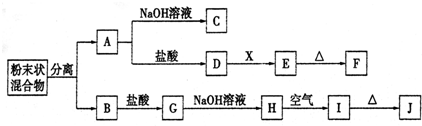
分析 I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe,J为Fe2O3;金属A能与盐酸、氢氧化钠溶液反应,A为计算Al;E为白色沉淀,为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3.
解答 解:I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe,J为Fe2O3;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3,
(1)由上述分析可知,F为Al2O3,G为FeCl2;
故答案为:Al2O3,FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
故答案为:利用磁铁吸出铁;
(3)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水(或碳酸钠、碳酸氢钠、偏铝酸钠)等,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)常用来检验G中阳离子的方法是,取少量溶液与试管中,滴入硫氰酸钾溶液,无现象,再滴入氯水后溶液变化为红色溶液,证明原溶液中含有亚铁离子;
故答案为:取少量溶液与试管中,滴入硫氰酸钾溶液,无现象,再滴入氯水后溶液变化为红色溶液,证明原溶液中含有亚铁离子.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,I的颜色及金属A能与盐酸、氢氧化钠溶液反应是推断突破口.


科目:高中化学 来源: 题型:选择题
| A. | NaCN和HCN 1:1组成的溶液呈酸性 | |
| B. | 0.1mol•l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 | |
| C. | 根据两个反应即可得出这三种酸的电离常数数值 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| B. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| C. | Y元素最高价氧化物对应的水化物的化学式为H3YO4 | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,将等浓度等体积的NaHSO4和Ba(OH)2溶液混合并充分反应后的溶液中:c(Ba2+)+c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向甲苯中滴加少量浓溴水并振荡静置,溶液分层且下层近无色,是因为发生了取代反应 | |
| C. | 可用稀盐酸酸化的BaCl2检验Na2SO3和Na2S2O3的混合液中是否混有Na2SO4 | |
| D. | 在与Al作用产生气体的溶液中一定不存在的离子组有:NO3-、Cl-、Na+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O | |
| B. | 铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu | |
| C. | 氢氧化铜和硫酸反应 OH-+H+=H2O | |
| D. | 硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸与铁反应可产生H2 | |
| B. | 浓硫酸可用于干燥O2、CO2 | |
| C. | 不可将水直接导入浓硫酸里进行稀释 | |
| D. | 浓硫酸对皮肤或者衣物有很强的腐蚀性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com