
(6分)请回答下列问题
(1)5L浓度为0.5mol/L的盐酸溶液中氯元素的质量为_________,该盐酸溶液恰好能使________g碳酸钙沉淀溶解
(2)已知少量SO2也能使澄清石灰水变浑浊,发生SO2+Ca(OH)2=CaSO3↓+H2O反应,若要使含3.7gCa(OH)2的澄清石灰水全部沉淀为CaSO3,则需要_________mol的SO2气体。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年河南信阳高级中学高一10月月考化学试卷(解析版) 题型:选择题
下列实验操作正确的是
A.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中
B.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称
D.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
在密闭容器中A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)表示。已知υ(A)、υ(B)、υ(C)之间有以下关系2υ(B)==3υ(A),3υ(C)==2υ(B)。则此反应可表示为
A.2A+3B==2C B.A+3B== 2C
C.3A+B==2C D.A+B==C
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆巴蜀中学高一上10月月考化学试卷(解析版) 题型:计算题
(11分)
(1)用14.2g无水硫酸钠配制成250mL溶液,其物质的量的浓度为 mol/L。
①若从中取出10mL,其物质的量的浓度为 mol/L。
②若将这10mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为 mol/L。若将稀释后的100mL溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCl2溶液 mL。
(2)400mL0.8mol/LH2SO4溶液(ρ=1.08g/cm3)和200mL98%浓硫酸(ρ=1.84g/cm3)混合,所得H2SO4稀溶液的密度为1.2g/cm3,则混合后稀H2SO4的物质的量的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆巴蜀中学高一上10月月考化学试卷(解析版) 题型:选择题
巴蜀中学的化学兴趣小组需要用到KNO3溶液。现有的KNO3溶液含有SO42-、Ca2+、Mg2+杂质,欲除去其中的杂质,可能需要下列化学药品和操作:①BaCl2溶液;②Ba(NO3)2溶液;③KOH溶液;④K2CO3溶液;⑤盐酸;⑥硝酸;⑦过滤,则下列药品加入顺序和操作顺序正确的是
A.③①④⑦⑤ B.②③④⑥⑦
C.③④②⑦⑥ D.②④③⑦⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一上学期10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.11.2L NO2含氧原子数为NA
B.标准状况下,14g CO所含质子数为7NA
C.22g某气体含分子数为0.5NA,则其摩尔质量为44
D.25℃,101KPa条件下,1.4g N2的体积为1.12L
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:选择题
将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各0.075 mol
B.稀硝酸的物质的量浓度为2.0 mol·L-1
C.第一次剩余4.8 g金属为铜和铁
D.向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L
查看答案和解析>>
科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:填空题
(9分)钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
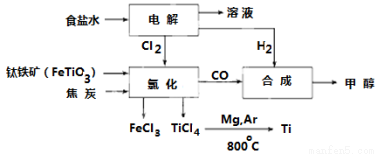
请回答下列问题:
(1)Fe位于元素周期表中第____________周期,第___________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:实验题
用 18 mol/L 的浓硫酸配制 100 mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤 ⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是________mL , 量取浓硫酸所用的量筒的规格是_________(用下列编号填空) 。 A.10 mL B.25 mL C.50 mL D.100 mL
(2)第③步实验的具体操作是_____________________________________
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至___________为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中 ______________;
②容量瓶用蒸馏水洗涤后残留有少量的水_________________;
③在转入容量瓶前烧杯中溶液未冷却至室温_________;
④加水超过刻度线后, 用胶头滴管吸出多余的液体___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com