
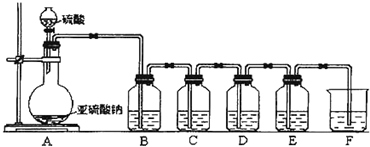
分析 (1)硫化氢与二氧化硫反应生成淡黄色沉淀S单质,据此写出反应的化学方程式;
(2)二氧化硫有毒,需要用氢氧化钠溶液吸收;二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应生成亚硫酸钠,据此写出反应的化学方程式;
(3)二氧化硫溶液显示酸性,能够使紫色石蕊试液变红;二氧化硫能够使品红溶液褪色;二氧化硫与硫化氢反应生成S单质,根据化合价变化可知二氧化硫表现了氧化性;二氧化硫具有还原性,能够与溴水发生氧化还原反应.
解答 解:(1)硫化氢与二氧化硫的反应为:H2S+SO2═3S↓+2H2O,所以D瓶中出现浅黄色沉淀,
故答案为:出现浅黄色沉淀;H2S+SO2═3S↓+2H2O;
(2)二氧化硫是一种有毒气体,为了避免污染空气,多余的二氧化硫需要用碱液吸收,二氧化硫与氢氧化钠溶液反应的化学方程式为:SO2+2NaOH═Na2SO3,
故答案为:除去SO2气体,避免污染空气;NaOH溶液; SO2+2NaOH═Na2SO3;
(3)二氧化硫溶液显示酸性,所以B中紫色石蕊试液变红,证明了二氧化硫具有酸性;二氧化硫通入C中的品红溶液时,品红溶液褪色,证明二氧化硫具有漂白性;二氧化硫与硫化氢发生反应为:SO2+2NaOH═Na2SO3,该反应中硫元素化合价从+4变为0价,化合价降低被还原,二氧化硫在反应中表现了氧化性;二氧化硫能够被溴水氧化呈硫酸,二氧化硫表现了还原性,
故答案为:酸性;漂白性;氧化性;还原性.
点评 本题考查了二氧化硫的制取与性质,题目难度中等,明确二氧化硫的性质及检验方法为解答关键,注意掌握二氧化硫漂白原理,试题侧重考查学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有④ | C. | 只有③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
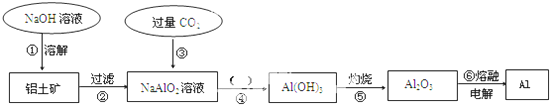
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为2 NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 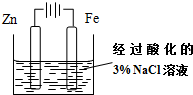 图为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀 | |
| B. | 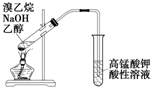 图所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| C. | 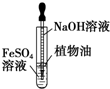 图所示装置可以用来制备氢氧化亚铁 | |
| D. | 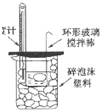 图所示装置可以用来测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、R的简单离子具有相同的电子层结构 | |
| B. | X2Y的熔点和沸点均比X2W高,是因为X2Y的分子内存在氢键 | |
| C. | X、Z分别与Y均可形成AB与A2B2型化合物,且A2B2均有较强的氧化性 | |
| D. | 由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com