
室温下,甲溶液中水电离出的H+浓度为10﹣12 mol•L﹣1,乙溶液中水电离出的H+浓度为10﹣2 mol•L﹣1,下列说法中正确的是( )
|
| A. | 甲、乙两溶液的pH不可能相同 |
|
| B. | 甲、乙两种溶液中加入Al粉都会产生H2 |
|
| C. | HCO3﹣ 不可能在甲、乙两溶液中大量共存 |
|
| D. | 甲不可能是盐溶液,乙不可能是酸或碱溶液 |
考点:
弱电解质在水溶液中的电离平衡;盐类水解的原理.
专题:
电离平衡与溶液的pH专题.
分析:
室温下,甲溶液中水电离出的H+浓度为10﹣12 mol•L﹣1<10﹣7 mol•L﹣1,说明甲中的溶质抑制水电离,为酸或碱或含有强酸根离子的酸式盐,乙溶液中水电离出的H+浓度为10﹣2 mol•L﹣1>10﹣7mol•L﹣1,且溶液中C(H+)>C(OH﹣),则溶液呈酸性,说明乙中的溶质促进水电离,为强酸弱碱盐,据此分析解答.
解答:
解:室温下,甲溶液中水电离出的H+浓度为10﹣12 mol•L﹣1<10﹣7 mol•L﹣1,说明甲中的溶质抑制水电离,为酸或碱或含有强酸根离子的酸式盐,乙溶液中水电离出的H+浓度为10﹣2 mol•L﹣1>10﹣7mol•L﹣1,且溶液中C(H+)>C(OH﹣),则溶液呈酸性,说明乙中的溶质促进水电离,为强酸弱碱盐,
A.如果甲溶液呈酸性,则溶液中pH=2,如果呈碱性,pH=12,乙溶液中的pH=2,故A错误;
B.甲溶液呈酸性或碱性,乙溶液呈酸性,如果酸是硝酸,则硝酸和铝反应不生成氢气,故B错误;
C.甲溶液呈酸性或碱性,乙溶液呈酸性,碳酸氢根离子和酸或碱都反应,所以碳酸氢根离子不可能在甲、乙两溶液中大量共存,故C正确;
D.甲溶液可能是盐溶液,如硫酸氢钠溶液,故D错误;
故选C.
点评:
本题考查弱电解质的电离和盐类水解,明确哪些物质能促进水电离哪些物质能抑制水电离是解本题的关键,易错选项是BD,注意规律外的特例,为易错点.


科目:高中化学 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g) 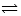 2W(g);△H<0,当充入 2 mol X和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W的体积分数减小,△H 增大
②以Y的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加1 molX,则 X 和Y的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通2 molX和1 molY,达到平衡时,X、Y的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素位于第三周期第ⅥA族.下列叙述不正确的是( )
|
| A. | 该元素是非金属元素 |
|
| B. | 该元素原子的核电荷数为16 |
|
| C. | 该元素原子核外有3个电子层 |
|
| D. | 该元素原子容易失去最外层电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各变化中,属于原电池反应的是( )
|
| A. | 在空气中金属铝表面迅速氧化形成保护层 |
|
| B. | 镀锌铁表面有划损时,也能阻止铁被氧化 |
|
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
|
| D. | 浓硝酸比稀硝酸更容易氧化金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在BaSO3(s)⇌Ba2+(aq)+SO32﹣ (aq)平衡体系中,下列措施可使沉淀量减少的是( )
|
| A. | 加入K2SO3(s) | B. | 加入稀HNO3 | C. | 加入稀盐酸 | D. | 加入K2SO4(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJ•mol﹣1、P﹣O:b kJ•mol﹣1、P=O:c kJ•mol﹣1、O=O:d kJ•mol﹣1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
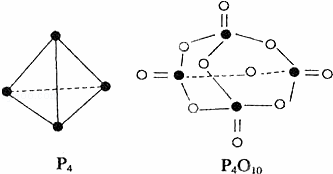
|
| A. | (6a+5d﹣4c﹣12b)kJ•mol﹣1 | B. | (4c+12b﹣6a﹣5d)kJ•mol﹣1 |
|
| C. | (4c+12b﹣4a﹣5d)kJ•mol﹣1 | D. | (4a+5d﹣4c﹣12b)kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,固定体积的容器中充入1mol SO2和1mol O2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法中不正确的是( )
|
| A. | 体系中的总反应是:2SO2+O2⇌2SO3 |
|
| B. | 在反应过程中NO是催化剂 |
|
| C. | NO参与反应历程,降低反应活化能,加快反应速率 |
|
| D. | NO的引入可以增加SO2的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com