
| A. | 非金属性比硫强 | B. | 阴离子比Br-半径小 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
分析 A、同主族从上到下元素的非金属性逐渐减弱;
B、电子层相同,核电荷越大半径越小;
C、同主族相邻的3、4两周期元素原子序数差18;
D、同主族从上到下元素的最高价氧化物的水化物碱性逐渐增强,酸性减弱.
解答 解:A、硒(Se)和硫同主族,同主族从上到下元素的非金属性逐渐减弱,所以硒(Se)的非金属性比硫弱,故A错误;
B、溴和硒同周期,电子层相同,核电荷越大半径越小,所以硒阴离子比Br-半径大,故B错误;
C、同主族相邻的3、4两周期元素原子序数差18,硫是16号,所以硒是34号,即原子序数为34,故C正确;
D、硒(Se)和硫同主族,硫的最高价氧化物的水化物硫酸是强酸性的,硒的最高价氧化物的水化物也显酸性,故D错误.
故选C.
点评 本题考查学生同一周期元素性质的递变规律,可以根据所学知识进行回答,难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | O2[PtF6]中只含离子键 | B. | O2[PtF6]中氧元素化合价为+1 | ||
| C. | 反应中O2是氧化剂,PtF6是还原剂 | D. | 每生成1molO2PtF6转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1A族均为碱金属元素 | |
| B. | 最外层有两个电子的原子一定在第ⅡA族 | |
| C. | 元素的最高化合价等于其原子的最外层电子数 | |
| D. | 第ⅦA族元素的阴离子还原性越强,其气态氢化物的稳定性越弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z中Z的单质最稳定 | B. | Y的氢化物为H2Y | ||
| C. | H2Z能发生反应:Cl2+H2Z=Z+2HCl | D. | Y有含氧酸为HYO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
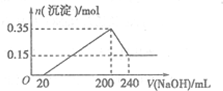 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
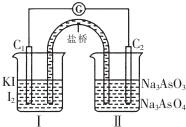 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:| A. | ①操作过程中C1棒上发生的反应为2I--2e-═I2 | |
| B. | ②操作过程中盐桥中的阳离子移向(Ⅰ)烧杯 | |
| C. | 若将微安表换成惰性电极电解饱和食盐水的装置,在①操作过程中与C1棒连接的电极上有Cl2产生 | |
| D. | 若将微安表换成电解精炼铜装置,在②操作过程中与C2棒连接的为纯铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于反应前后分子数相等,所以加压后,平衡不移动 | |
| B. | 平衡时c(H2O)(g)、c(CO)、c(H2)保持不变 | |
| C. | 达到平衡时,c(H2O)(g)═c(CO)=c(H2) | |
| D. | 升高温度,V正增大,V逆减小,所以平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O,△H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com