
| A. | NA个N2分子和NA个CO分子的质量之比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对分子质量之和 | |
| C. | 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同 | |
| D. | 1 mol N2的质量等于NA个氮原子的质量 |
分析 A.N2与CO的摩尔质量相同,物质的量均为1 mol,故质量之比为1:1;
B.摩尔质量单位为g•mol-1,相对分子质量单位为1;
C.水、冰、水蒸气为H2O的三种不同存在状态,为同一物质;
D.每个N2分子由两个氮原子构成,1mol N2的质量应等于2 NA个氮原子的质量.
解答 解:A.N2与CO的摩尔质量相同,物质的量均为1 mol,故质量之比为1:1,故A正确;
B.摩尔质量单位为g•mol-1,相对分子质量单位为1,不能等同,故B错误;
C.水、冰、水蒸气为H2O的三种不同存在状态,为同一物质,分子数相同的条件下质量相同,故C错误;
D.每个N2分子由两个氮原子构成,1mol N2的质量应等于2 NA个氮原子的质量,故D错误;
故选A.
点评 本题考查物质的量为中心的计算,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同质量、不同密度的O2和O3 气体 | B. | 同温度、同体积的O2和O3气体 | ||
| C. | 同压强、同体积的N2O和CO2气体 | D. | 同体积、同密度的N2O和CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ①④⑤⑦ | C. | ②③④⑥ | D. | ④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>③>④ | |
| B. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol•L-1盐酸、③0.1mol•L-1氯化镁溶液、④0.1mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| C. | 常温下将NaHSO3和NaHCO3两溶液混合后,溶液呈中性,则混合后的溶液中:c (Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-) | |
| D. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
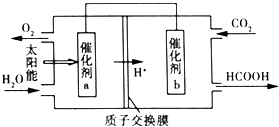
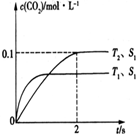 目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com