
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$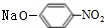 +NaCl+H2O.
+NaCl+H2O.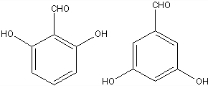 、
、 (任意一种).
(任意一种). 分析 由羟苯水杨胺结构简式、F的分子式可知,F为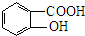 ,E为
,E为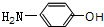 ,由反应信息逆推可知D为
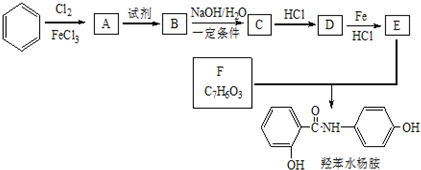
,由反应信息逆推可知D为 ,由转化关系可知,苯与氯气发生取代反应生成A为
,由转化关系可知,苯与氯气发生取代反应生成A为 ,A与浓硝酸、浓硫酸在加热条件下发生取代反应生成B为
,A与浓硝酸、浓硫酸在加热条件下发生取代反应生成B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C酸化得到D,据此解答.
,C酸化得到D,据此解答.
解答 解:由羟苯水杨胺结构简式、F的分子式可知,F为 ,E为
,E为 ,由反应信息逆推可知D为
,由反应信息逆推可知D为 ,由转化关系可知,苯与氯气发生取代反应生成A为
,由转化关系可知,苯与氯气发生取代反应生成A为 ,A与浓硝酸、浓硫酸在加热条件下发生取代反应生成B为
,A与浓硝酸、浓硫酸在加热条件下发生取代反应生成B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C酸化得到D.
,C酸化得到D.
(1)由羟苯水杨胺的结构简式,可知其化学式为C13H11NO3,
A.1mol羟苯水杨胺含有2mol酚羟基,水解得到1mol-COOH,最多可以和3mol NaOH反应,故A错误;
B.苯环可以发生硝化反应,故B错误;
C.含有-CONH-,可发生水解反应,故C正确;
D.含有酚羟基,可与溴发生取代反应,故D正确;
故答案为:C13H11NO3;CD;
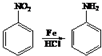
(2)D为 ,名称为对硝基苯酚,故答案为:对硝基苯酚;
,名称为对硝基苯酚,故答案为:对硝基苯酚;
(3)A→B所需试剂为:浓硝酸和浓硫酸,D→E是硝基还原为氨基,属于还原反应,
故答案为:浓硝酸和浓硫酸;还原反应;
(4)B→C反应的化学方程式为: +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$ +NaCl+H2O,
+NaCl+H2O,
故答案为: +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$ +NaCl+H2O;
+NaCl+H2O;
(5)F( )的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,说明含有酚羟基、醛基,侧链为-OH、-OOCH时,有邻、间、对3种,侧链可为-CHO、2个-OH,2个-OH处于邻位,-CHO有2种位置,2个-OH处于间位,-CHO有3种位置,2个-OH处于对位,-CHO有1种位置,其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式为:
)的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,说明含有酚羟基、醛基,侧链为-OH、-OOCH时,有邻、间、对3种,侧链可为-CHO、2个-OH,2个-OH处于邻位,-CHO有2种位置,2个-OH处于间位,-CHO有3种位置,2个-OH处于对位,-CHO有1种位置,其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式为: 、
、 ,
,
故答案为: 、
、 (任意一种).
(任意一种).
点评 本题考查有机物推断、官能团结构与性质、限制条件同分异构体书写等,根据羟苯水杨胺结构确定E,再结合转化条件进行推断,较好的考查学生分析推理能力、知识迁移运用能力,熟练掌握掌握官能团的性质.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
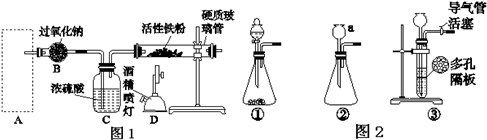
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60的摩尔质量是837 | |
| B. | 1 mol K3C60中含有的离子数目为63×6.02×1023 | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式可写为KC20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色,常作植物生长调节剂; ②比例模型如图所示:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型如图所示: 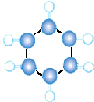 |
| C | ①C、H、O三种元素组成; ②与Na反应产生H2; ③与D反应可生成酯. |
| D | ①C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
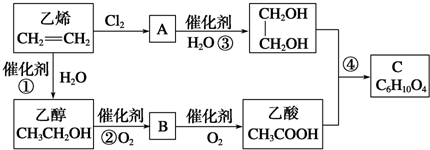
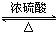
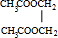 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 | |
| B. | 湿法中FeO42-是氧化产物;干法中O2也是氧化产物 | |
| C. | 干法中每生成1mol Na2FeO4,这个反应共转移4mol电子 | |
| D. | 高铁酸钠中铁显+6价,它在氧化还原反应中通常被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式为-COH | |
| B. | 乙烯和乙醇都能使溴水和酸性KMnO4溶液褪色 | |
| C. | 乙酸乙酯中的官能团为酯基(-COO-),能发生水解反应 | |
| D. | 苯能与氢气发生加成反应,是因为苯分子中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9mol•L-1 | B. | 6mol•L-1 | C. | 3mol•L-1 | D. | 2mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com