
分析 (1)根据CO2通入Ca(OH)2的反应实质:CO2~Ca(OH)2~CaCO3~CO2~Ca(HCO3)2来回答;
(2)根据沉淀的质量确定二氧化碳的生成量,根据氧化物质量等于构成化合物的铁元素和氧元素质量之和来确定氧化物的化学式.
解答 解:(1)根据CO2通入Ca(OH)2的反应实质:CO2~Ca(OH)2~CaCO3~CO2~Ca(HCO3)2,0.01mol Ca(OH)2的澄清石灰水可以和0.01mol二氧化碳完全反应全部转化为沉淀,再通入的二氧化碳会将沉淀逐渐溶解,所以当n(CO2)>0.01mol时,白色沉淀开始溶解;故答案为:0.01;
(2)因为0.01mol Ca(OH)2的澄清石灰水完全反应生成白色沉淀1g>0.75g,所以有0.25g的碳酸钙会溶解,CO还原铁的氧化物实际生成二氧化碳0.0125g,则0.9g铁的氧化物中,m(O)=0.0125mol×16g/mol=0.2g,m(Fe)=0.9g-0.2g=0.7g,n(Fe):n(O)=$\frac{0.7}{56}:\frac{0.2}{16}$=1:1,级铁的氧化物的化学式为:FeO,答:铁的氧化物的化学式为FeO.
点评 本题考查了复杂化学式的确定,利用原子守恒计算铁的氧化物中氧、铁元素的物质的量是解本题的关键,再根据物质的量之比等于原子个数之比,从而确定氧化物的化学式.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL0.10mol•L-1FeCl3溶液中,Fe3+的离子数目为0.01NA | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有SO42-的总数为0.1NA | |
| C. | 7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状态下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子最外层电子数:Z>X>Y | B. | 单质沸点:X>Y>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①H2S、H2SO4、HNO3、H2SO3、HNO2、H2CO3 | ②KOH、NaOH | ③NH4NO3 | ④CO2 ⑤Na2O2 |
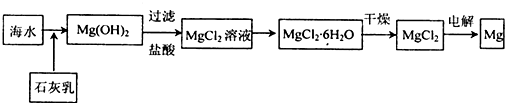
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiH、LiD、LiT互为同素异形体 | |
| B. | LiH、LiD、LiT中氢元素的化合价均为+1 | |
| C. | H、D、T之间互称为同位素 | |
| D. | LiH、LiD、LiT在反应中常作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
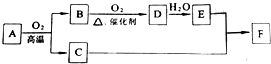 物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.
物质A~F有如图所示转化关系(部分生成物未列出),其中A为某金属矿物的主要成分,C是铁红的主要成分.E的浓溶液能与铜发生并有B生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钠溶液和苛性钠溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L的氧气所含的分子数为NA | |
| B. | 含Cl-数目为0.4NA的CaCl2溶液,CaCl2的物质的量浓度是0.2mol/L | |
| C. | 1.8gNH4+ 中含有的电子数为NA | |
| D. | 标准状况下,含NA个氮原子的N2 和N2O混合气体中,N2 的体积是5.6L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com