
Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�顣
ʵ���Ӧ����Ķ���̽����
ʵ��װ����ͼ��ʾ�����̶�װ������ȥ��

(1)A�з�Ӧ�Ļ�ѧ����ʽΪ ��
(2)F�ձ��е���Һͨ���� ��
(3)ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������
��
(4)ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ��������� ��
(5)Ϊ˵��Ũ�����е�ˮ�Ƿ�Ӱ��Bװ��������жϣ��������һ��ʵ�顣ʵ�鷽��Ϊ ��
ʵ���Ӧ����Ķ���̽��
(6)��ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣�������������������ϡ�
����1��
| ����/mol·L��1 | ��ɫ���ʳ��ֵ��¶�/�� | ��ɫ������ʧ���¶�/�� |
| 15 | Լ150 | Լ236 |
| 16 | Լ140 | Լ250 |
| 18 | Լ120 | ����ʧ |
����2��X-���߾������������ͭ��Ũ���ᷴӦ���ɵĺ�ɫ����ΪCu2S��CuS��Cu7S4�е�һ�ֻ��֡������������Ͽɵó�����ȷ������ __��
a��ͭ��Ũ���ᷴӦʱ���漰�ķ�Ӧ���ܲ�ֹһ��
b������Ũ��ѡ���ʵ����ɱ����������г��ֺ�ɫ����
c���÷�Ӧ����������֮һ������Ũ�ȡ�15 mol/L
d������Ũ��Խ��ɫ����Խ����֡�Խ����ʧ
(7)Ϊ�������ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00 mL��Һ��ȡ����Һ25.00 mL��������KI��Һ���Ե�����ҺΪָʾ������b mol/L Na2S2O3��Һ�ζ����ɵ�I2��3��ʵ��ƽ�����ĸ�Na2S2O3��ҺV mL������Ӧ����ͭ������Ϊa g��������ͭ�IJ���Ϊ _������֪��2Cu2����4I��===2CuI��I2��2S2O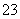 ��I2===S4O
��I2===S4O ��2I����
��2I����
��֪ʶ�㡿��Ԫ���γɵĻ���������ʣ���ѧ����
���𰸽�����(1)Cu+2H2SO4(Ũ)  CuSO4 +SO2+2H2O
CuSO4 +SO2+2H2O
(2)����������Һ�������Եĸ��������Һ�ȣ�
(3)Dװ���к�ɫ������ɫ�ޱ仯��E����Һ��ɫ��
(4)��Aװ�����Թ�����ȴ�Ļ�����ر��ڣ�����������������ʢ��ˮ���ձ��У������Ͻ��裬����Һ�Ƿ����
(5)ʹ������װ�ã�������ͭ˿����ʵ�飬�۲���ˮ����ͭ�Ƿ����
(6)abd
(7)0.64Bv/a
������(2)�ڴ˷�Ӧ�в��������Ե����壬�ʿ����� ��Һ���գ���������Ҫ��SO2���壬��Ҳ����ѡ�������Ե���Һ�������ա�
(3)�����������������������ͭ��ԭ�����û����������ͭ����ɫ���ᷢ���ı䣬����Ļ�ԭ����ΪSO2��֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ء�
(4)ͭ������ϡ��Һ�е���ɫ����ɫ�����Լ���ͭ����ʱҪ��ϡ��Һ�С�
(6) a�� ͭ��Ũ���ᷴӦ��Cu+2H2SO4(Ũ)  CuSO4 +SO2+2H2O����X-���߾������������ͭ��Ũ���ᷴӦ��������ͭ���������ͭ��Ũ���ᷴӦʱ���漰�ķ�Ӧ���ܲ�ֹһ����b��������1����ʾ����Ũ��Ϊ18 mol/Lʱ����ɫ���ʲ���ʧ������15 mol/L��15 mol/Lʱ�ǿ�����ʧ�ģ�������Ũ��ѡ���ʵ����ɱ����������г��ֺ�ɫ���ʣ�c���÷�Ӧ�����г����˺�ɫ�����Ҳ���ʧ�ʸ÷�Ӧ����Ũ�ȡ�18 mol/L��d��������1����ʾ����Ũ��18 mol/Lʱ��ɫ���ʳ��ֵ��¶ȵͣ���������ʧ��������Ũ��Խ��ɫ����Խ����֡�Խ����ʧ��
CuSO4 +SO2+2H2O����X-���߾������������ͭ��Ũ���ᷴӦ��������ͭ���������ͭ��Ũ���ᷴӦʱ���漰�ķ�Ӧ���ܲ�ֹһ����b��������1����ʾ����Ũ��Ϊ18 mol/Lʱ����ɫ���ʲ���ʧ������15 mol/L��15 mol/Lʱ�ǿ�����ʧ�ģ�������Ũ��ѡ���ʵ����ɱ����������г��ֺ�ɫ���ʣ�c���÷�Ӧ�����г����˺�ɫ�����Ҳ���ʧ�ʸ÷�Ӧ����Ũ�ȡ�18 mol/L��d��������1����ʾ����Ũ��18 mol/Lʱ��ɫ���ʳ��ֵ��¶ȵͣ���������ʧ��������Ũ��Խ��ɫ����Խ����֡�Խ����ʧ��
(7)����2Cu2����4I��===2CuI��I2��2S2O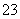 ��I2===S4O
��I2===S4O ��2I�����õ�
��2I�����õ�
Cu2�� �� S2O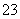
n (S2O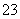 )=V��10—3 L��b mol/L��10= V b��10—2 mol= n (Cu2��)= n (CuSO4) ʵ�ʷ�Ӧ����ͭ������Ϊa g��n (Cu)=a/64 mol�����۲�����n (CuSO4)����= a/64 mol
)=V��10—3 L��b mol/L��10= V b��10—2 mol= n (Cu2��)= n (CuSO4) ʵ�ʷ�Ӧ����ͭ������Ϊa g��n (Cu)=a/64 mol�����۲�����n (CuSO4)����= a/64 mol
������ͭ�IJ���Ϊ n (CuSO4) ʵ��/n (CuSO4)����=0.64Bv/a
��˼·�㲦�����⿼��ѧ����ʵ��ԭ�������⡢ʵ�鷽�������ۡ�ʵ��װ�õ����������ۣ��Ѷ��еȣ���Ӧ����Ķ���̽���п�����Ϣ����Ч���ã���ѧ�����жಽ��Ӧ�е����Ĺ�ϵ���ۺ��Խ�ǿ��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ˮ��þ����Ҫ��Դ֮һ���Ӻ�ˮ����ȡþ�ɰ����²�����У��ٰѱ����Ƴ�ʯ���飻��������ĺ�ˮ�м���ʯ���飬������ϴ�ӡ����˳�����۽������������ᷴӦ���ᾧ�����ˡ��������ܵ�⣻�ݵõ�������й�����ȡþ��˵���У�����ȷ����(����)
A���˷����ŵ�֮һ��ԭ��ȡ�Դ�
B�����Т٢ڢ۲����Ŀ���Ǹ���MgCl2
C�����õ����������þ�ķ�����ȡþ
D����ⷨұ������Ҫ���Ĵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ����٤��������ֵ������˵������ȷ����
A.�����£�1mol���麬�е���ԭ����Ϊ4NA B.2g����������ԭ����Ϊ0.5NA
C.0.1mol/L����������Һ�к�SO42-��Ϊ0.3NA D.18gˮ����������Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1.52gͭþ�Ͻ���ȫ�ܽ���50mL��
��Ϊ1.40g·mL-1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120mL(��״��)����Ӧ�����Һ�м���1.0mol·L-1NaOH��Һ������������ȫ������ʱ���õ�2.54g������
��1���úϽ���ͭ��þ�����ʵ���֮���� ��
��2��NO2��N2O4�Ļ�������У�NO2����������� ��
��3���õ�2.54 g����ʱ������NaOH��Һ������� mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���е����ʵ�����ͭ�����Ļ����17.2 g����50.0 mL
��Ũ����ǡ����ȫ��Ӧ��
��������4.48 L(��״��)��������˵����ȷ����
A��������������0.2 mol NO2
B����������ʵ���Ũ��Ϊ12 mol·L��1
C����Ӧ�б���ԭ��δ����ԭ���������ʵ���֮��Ϊ3��2
D��Ҫʹ����������ǡ����ȫ��ˮ������Ҫͨ������0.075 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ����
A�������ʵ�����Ba(OH)2������[KAl(SO4)2·12H2O]��������ˮ�У�
3Ba2����6OH����2Al3����3SO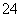 ===3BaSO4����2Al(OH)3��
===3BaSO4����2Al(OH)3��
B��Fe(OH)3��������Fe(OH)3��3H��===Fe3����3H2O
C��H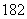 O��Ͷ��Na2O2���壺2H
O��Ͷ��Na2O2���壺2H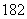 O��2Na2O2===4OH����4Na����18O2��
O��2Na2O2===4OH����4Na����18O2��
D��CuCl2��Һ�м���H2S��Һ��Cu2����S2��===CuS��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ɫ����������Һ�У��ܴ����������
A��Na+��K+��CO32����NO3�� B��K+��Fe2+��NH4+��NO3��
C��NH4+��Al3+��SO42����NO3�� D��K+��Na+��NO3����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݱ�����Ϣ�жϣ�����ѡ���ȷ����
| ��� | ��Ӧ�� | ���� |
| �� | KMnO4��H2O2��H2SO4 | K2SO4��MnSO4�� |
| �� | Cl2��FeBr2 | FeCl3��FeBr3 |
| �� | MnO | Cl2��Mn2���� |
A���ڢ��鷴Ӧ���������ΪH2O��O2
B���ڢ��鷴Ӧ��Cl2��FeBr2�����ʵ���֮��Ϊ1��2
C���ڢ��鷴Ӧ������1 mol Cl2��ת�Ƶ���2 mol
D����������ǿ����˳��ΪMnO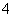 >Cl2>Fe3��>Br2
>Cl2>Fe3��>Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾװ���У���NaOH��Һ����м��ϡH2SO4���Լ��Ʊ���ɫ��Fe(OH)2������

(1)���Թܢ��������Լ���____________��
(2)���Թܢ��������Լ���____________��
(3)Ϊ���Ƶð�ɫFe(OH)2���������Թܢ�͢��м����Լ�����ֹˮ�У��������Ӻ��ʵ�鲽����________________________________________________��
(4)�������ɵ�Fe(OH)2�����ܽϳ�ʱ�䱣�ְ�ɫ����������_______________ __________________________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com