
 ����1��12�գ��ҹ�3��DZˮԱԲ������״�300�ױ���DZˮ��ҵ��ʵ�֡�������
����1��12�գ��ҹ�3��DZˮԱԲ������״�300�ױ���DZˮ��ҵ��ʵ�֡�������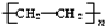 ����ͼ������ij����Ͱ�ϵı�־���ñ�־�ĺ����ǿɻ����
����ͼ������ij����Ͱ�ϵı�־���ñ�־�ĺ����ǿɻ���� ���� �ٸ��������ڳ�ʪ�����з����绯ѧ��ʴ��Fe��������ʧȥ���ӷ���������Ӧ��
����֬�Ǹ�֬�����������������ˮ�����ɰ����
�۾���ϩ����ϩ�Ӿ����ɣ�ͼΪ�ɻ����
��� �⣺�ٸ��������ڳ�ʪ�����з����绯ѧ��ʴ��Fe��������ʧȥ���ӷ���������Ӧ���为���ĵ缫��Ӧʽ��Fe-2e-=Fe2+��
�ʴ�Ϊ���绯ѧ��Fe-2e-=Fe2+��
����֬�������з���ˮ�����ɸ��ͺ�֬���ᣬ��������ø��������ˮ�����ɰ����ᣬ�ʴ�Ϊ����֬��������
�۾���ϩ����ϩ�����Ӿ۷�Ӧ�õ����ṹ��ʽΪ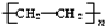 ��ͼΪ�ɻ�����ʴ�Ϊ��
��ͼΪ�ɻ�����ʴ�Ϊ��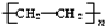 ���ɻ����
���ɻ����
���� ���⿼���˵缫��Ӧʽ��д�����ʵ����ʣ��ѶȲ������ո����ĵ绯ѧ��ʴԭ�������ʵ������ǽ���Ĺؼ���ע�⻯ѧ���������ϵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
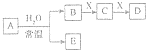 ��ѧ��������A��B��C��D��E��X���ɶ�����Ԫ����ɣ��Ҵ�����ͼת����ϵ�����ַ�Ӧ�������ͷ�Ӧ������ȥ���������ƶϲ���ȷ���ǣ�������
��ѧ��������A��B��C��D��E��X���ɶ�����Ԫ����ɣ��Ҵ�����ͼת����ϵ�����ַ�Ӧ�������ͷ�Ӧ������ȥ���������ƶϲ���ȷ���ǣ�������| A�� | ��X��Na2SO3��C����ʹƷ����Һ��ɫ�����壬��A��������������D��E����Ӧ | |
| B�� | ��A�ǵ��ʣ�B��D�ķ�Ӧ��OH-+HCO3-�TH2O+CO32- ��E-���ܻ�ԭCuO | |
| C�� | ��B��X��Ϊ���ʣ�DΪCO��C�ܺ�E��Ӧ����EΪNaOH | |
| D�� | ��DΪ��ɫ����������A��Ħ��������ȣ���Xһ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1molCu��������Ũ���ᷴӦ������SO3������Ϊ0.1NA | |
| B�� | ��״���£�5.6LCO2������Na2O2��Ӧת�Ƶĵ�����Ϊ0.5NA | |
| C�� | ���³�ѹ�£�6.0g SiO2���е�SiO2������Ϊ0.1NA | |
| D�� | ��ҵ�Ͻ������������ڴ��������·���������Ӧ�����б�״����V L������ȫ��Ӧ����ת��n�����ӣ����ӵ�����NA�ɱ�ʾΪ��$\frac{22.4n}{5V}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4HCO3���ڹ�����ŨKOH��Һ�в����ȣ�NH4++HCO3-+2OH-=$\frac{\underline{\;\;��\;\;}}{\;}$CO32-+NH3��+2H2O | |
| B�� | ��������Һ�еμ�Ba��OH��2��Һ��ǡ��ʹSO42-������ȫ��2Al3++3SO42-+3Ba2++6OH -�T2 Al��OH��3��+3BaSO4�� | |
| C�� | ��FeI2��Һ��ͨ������������2Fe2++Cl2�T2Fe3++2Cl- | |
| D�� | ��������������ϡ���3Fe2++4H++NO3-�T3Fe3++NO��+3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
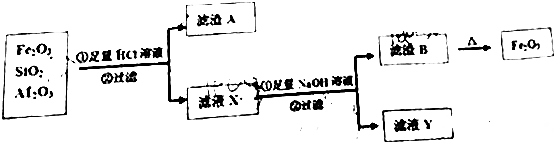
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����� | B�� | �������� | C�� | �� | D�� | ����Ͻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O��CH4��HF | B�� | ���ס��� | ||
| C�� | CO2��SO2��NO2 | D�� | H2SO4��CH3CH2OH��HCHO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
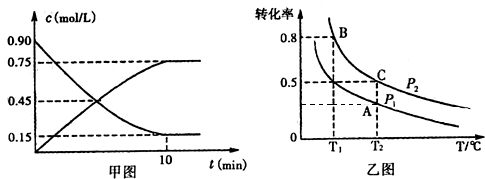
| NH3•H2O | H2SO3 | ||
| ����ƽ�ⳣ����mol/L�� | 1.7��10-5 | Ka1 | Ka2 |
| 1.54��10-2 | 1.02��10-7 | ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com