
 现有A、B、C、D、E五种短周期非金属元素,其原子序数依次增大.A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等.C、E是同主族元素,它们的核外均有3个未成对电子.请回答下列问题:
现有A、B、C、D、E五种短周期非金属元素,其原子序数依次增大.A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等.C、E是同主族元素,它们的核外均有3个未成对电子.请回答下列问题:分析 A、B、C、D、E五种短周期非金属元素,其原子序数依次增大.A是原子半径最小的元素,则A为H元素;B元素的一种核素可用于考古断代,而14C常用于鉴别文物的年代,则B为C元素;D元素的s轨道和p轨道上的电子数相等,其电子排布式应为1s22s22p4,则D为O元素,C为N元素;C、E是同主族元素,它们的核外均有3个未成对电子,且为主族元素,可知E为P元素,据此分析解题.
解答 解:由分析可知:A为H元素、B为C元素、C为N元素、D为O元素、E为P元素;
(1)基态P原子的核外电子排布式为1s22s22p63s23p3,则其核外有5种能量不同的电子,故答案为:5;
(2)电负性是指得电子能力,元素的非金属性越强,电负性越大,五种元素中O元素的非金属性最强,则电负性最大;第一电离能是指失电子能力,第一电离能越大易难失电子,同周期随核电荷数增大呈增大趋势,同主族随核电荷数增大而减小,因N的2p轨道为半充满结构,相对稳定,不易失电子,第一电离能最大,故答案为:O;N;
(3)NH3因分子间存在氢键,而CH4分子间只存在范德华力,则NH3的沸点大于CH4,故答案为:NH3分子间能形成氢键;
(4)NO2中N原子形成2个δ键,孤对电子数为1,则NO2的立体构型是V型,其中N原子的杂化类型为sp2,故答案为:V型;sp2;
(5)N2H4易溶于水,它是与氨类似的弱碱,则N2H4与水电离的H+结合生成N2H5+,促进水的电离,生成OH-,电离方程式为N2H4+H2O=N2H5++OH-;
故答案为:N2H4+H2O=N2H5++OH-;
(6)该晶胞中Mg原子=8×$\frac{1}{8}$+1=2,H原子个数=2+4×$\frac{1}{2}$=4,晶胞中含有2个MgH2,其密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×2}{V}$=$\frac{\frac{26}{{N}_{A}}×2}{V}$g/cm3=$\frac{52}{{V{N_A}}}$g/cm3,故答案为:$\frac{52}{{V{N_A}}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、元素周期律判断、原子核外电子排布、分子杂化与立体构型分析等知识点,其中准确推断元素是解题关键,侧重考查学生分析计算能力,注意晶胞计算中均摊法的应用,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
 室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )
室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )| A. | 随着盐酸加入,溶液中水的电离程度逐渐增大 | |
| B. | 随着盐酸加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | M 点,n(H+)-n(OH-)=(a×10-4-0.01)mol | |
| D. | 当 V(盐酸)=200mL时,c(CH3COO-)+c(CH3COOH)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
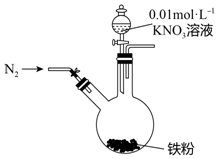 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:| 实验步骤 | 实验现象 |
| 1.打开弹簧夹,缓慢通入N2 | |
| 2.加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着. |
| 3.反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化. |
| 4将剩余固体过滤 | 表面的白色物质变为红褐色. |
| 实验步骤 | 实验现象 |
| 1.取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2.将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3.另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸. | 有气体生成,该气体使红色石蕊试纸变蓝. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 甲烷是一种比较洁净的能源 | |
| C. | 石油的主要成分是各种碳氢化合物组成的混合物 | |
| D. | 甲烷的二氯代物无同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )是苯的含氧衍生物,在化妆品中可作防腐剂.其一种同分异构体M,满足如下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种.尼泊金甲酯的另一种同分异构体N,能发生银镜反应,也能与NaOH溶液反应生C8H7O3Na.下列推论合理的是( )
)是苯的含氧衍生物,在化妆品中可作防腐剂.其一种同分异构体M,满足如下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种.尼泊金甲酯的另一种同分异构体N,能发生银镜反应,也能与NaOH溶液反应生C8H7O3Na.下列推论合理的是( )| A. | lmol尼泊金甲酯能与1molNaOH反应生成对应的钠盐 | |
| B. | 符合题述条件的有机物M有两种 | |
| C. | 有机物N一定不能发生酯化反应 | |
| D. | 符合条件的有机物M易溶于水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com