
| A. | $\frac{V}{2}$L | B. | $\frac{V}{3}$L | C. | $\frac{5V}{6}$L | D. | VL |
分析 发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2,方程式叠加可得2Na2O2+2NO+2CO2═2Na2CO3+2NO2,
若CO2、NO按1:1恰好反应,则反应后气体体积为开始的一半,
若CO2:NO>1:1,则发生2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2NO+2CO2═2Na2CO3+2NO2,则反应后气体体积仍为开始的一半,
若CO2:NO<1:1,则发生2Na2O2+2NO+2CO2═2Na2CO3+2NO2,还有过量的NO,则反应后气体体积大于开始的一半,以此解答该题.
解答 解:在常温常压下有CO2和NO混合气体VL,用足量Na2O2固体缓慢、充分吸收后,发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2,方程式叠加可得2Na2O2+2NO+2CO2═2Na2CO3+2NO2,
若CO2、NO按1:1恰好反应,则反应后气体体积为开始的一半,即x=$\frac{V}{2}$;
若CO2:NO>1:1,则发生2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2NO+2CO2═2Na2CO3+2NO2,则反应后气体体积仍为开始的一半,即x=$\frac{V}{2}$;
若CO2:NO<1:1,则发生2Na2O2+2NO+2CO2═2Na2CO3+2NO2,还有过量的NO,则反应后气体体积大于开始的一半,即V>x>$\frac{V}{2}$,
题中只有C正确.
故选C.
点评 本题考查氧化还原反应以及混合物的有关计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的化学方程式,关键是利用总反应方程式解答简化计算过程,注意差量法的应用,难度不大.


科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是
A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时粗铜做阳极
C.在镀件上镀铜时可用金属铜做阳极 D.电解水制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
下面一些报道中,你认为科学的是( )
A.疏通煤气管道时,充入氩气引起爆炸
B.新粉刷过石灰浆的墙壁释放出CO2使一老汉窒息而死
C.有易燃易爆物的工作场所,严禁穿化纤衣服
D.本饮料纯天然,绝对不含化学物质
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<c+d | B. | A的转化率增大 | ||
| C. | D的体积分数变大 | D. | 平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.024mol | B. | 0.006mol | C. | 0.075mol | D. | 0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;氯离子的电子式
;氯离子的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
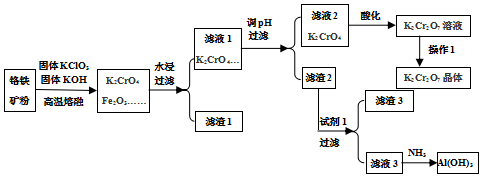
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com