
【题目】如图1所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图2所示.

(1)关闭K1,打开K2,通电后,B中的KMnO4紫红色液滴向c端移动,则电源b端为__极,通电后,滤纸d端的电极反应式是__.
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是__.
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是__.
【答案】负2H++2e﹣=H2↑Cu2+>H+>X3+在C端开始时有无色无味气体产生,一段时间后有红色物质析出
【解析】
(1)关闭K1,打开K2,为电解饱和食盐水装置,通电后,B的KMnO4紫红色液滴向c端移动,根据电解池工作原理可知阴离子向阳极移动判断电源的正负极并书写d端的电极反应式;(2)打开K1,关闭K2,则为电解C、D两池,根据电解C的图象可知,开始即析出固体,总共0.2mol电子通过时,析出固体质量达最大,证明此时析出的固体是铜,此后,继续有电子通过,不再有固体析出,说明X3+不放电,H+放电,从而判断离子氧化性;D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,据此分析可得结论。
(1)据题意B中的KMnO4紫红色液滴向c端移动,说明高锰酸根离子向c端移动,可推出极c端为阳极,则与之相连的电源a端为正极,b端为负极,所以通电滤纸d端为阴极,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(2)根据电解C的图象可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这时阴极产生的是氢气,即电解水,说明氧化能力H+>X3+,故答案为Cu2+>H+>X3+;
(3)D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始为氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,所以看到的现象为在C端开始时有无色无味气体产生,一段时间后有红色物质析出;故答案为:在C端开始时有无色无味气体产生,一段时间后有红色物质析出。


科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:

Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。
(已知:![]() )
)
回答下列问题:
(1)反应瓶中前后通入氮气的目的分别是________________、_________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是____,若只使用一个吸收管,会导致测定结果偏____(填“高”或“低”)。
(4)实验室常用FeS固体与酸常温下反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是_______________(填序号)。

(5)上图a中盛装液体药品的玻璃仪器名称为________。
(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CaCO3难溶于水,是弱电解质
B. 进行中和滴定操作时眼睛应注视锥形瓶中溶液颜色的变化
C. 用pH试纸测溶液的pH应预先润湿
D. 蒸干FeCl3溶液可得到FeCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4在生产、生活、卫生医疗中常用作消毒剂,高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这两种氧化剂性质的探究。
(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(2)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.395 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.50 mL,则该样品中KMnO4的质量分数是________。(有关离子方程式为:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。溶液先变为浅绿色的离子方程式是_______________,又变为棕黄色的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是( )
A.铝合金大量用于高铁建设
B.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
C.高纯硅可用于制作光感电池
D.氢氧化铝可用于中和过多胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中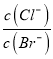 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com