
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
下列描述不符合生产、生活实际的是
A.家用炒锅残留盐溶液时易发生吸氧腐蚀
B.电解法精炼粗铜,用纯铜作阴极
C.电解水制氢气时,用铜作阳极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
使用一种试剂就能鉴别出来的一组物质是 ( )
A、甲苯 己烯 苯 乙醇 B、甲苯 己烯 CCl4 乙醇
C、硝基苯 苯 溴乙烷 乙醇 D、苯 甲苯 二甲苯 乙醇
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是
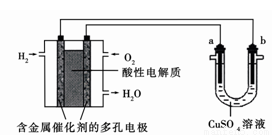
A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是含锌、铁的粗铜,b极是纯铜, a极溶解铜的质量与b极析出铜的质量相等
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
A.v正 增大,v逆减小 B.v正减小,v逆增大
C.v正和v逆同程度的减小 D.v正和v逆不同等程度的减小
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ 在①CH2=CH2 ②C6H6 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是________;
(2)属于高分子化合物的是________;
(3)能与Na2CO3溶液反应的是________;
(4)能发生酯化反应的是________;
(5)既能发生取代反应又能发生加成反应的是________。
Ⅱ A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量一定,完全燃烧后所产生的CO2的质量就不变,试写出两组符合上述情况的烃的结构简式:
(1)第一组 和 。
(2)第一组 和 。
(3)A、B应满足的条件是_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸
氧腐蚀相同。下列分析正确的是
A.含有 1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
B.脱氧过程是吸热反应,可降低温度,延长糕点保质期
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-
D.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
A.阴极 B.阳极 C.正极 D.负极
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:填空题
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
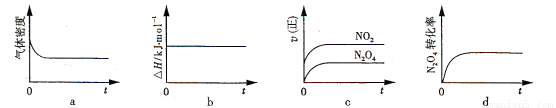
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com