
 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。  2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )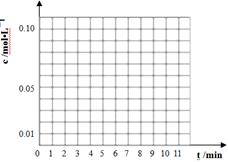
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
 2(t-BuNO)
2(t-BuNO)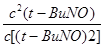 =
=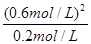 =1.8(2分)
=1.8(2分)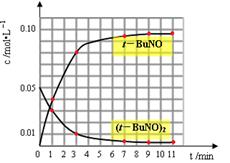
 2(t-BuNO)
2(t-BuNO)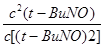 =
=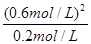 =1.8(2分)
=1.8(2分)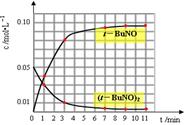


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:不详 题型:填空题
 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示: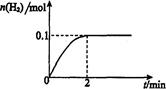
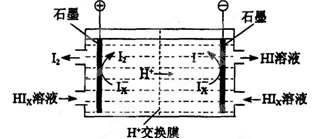
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
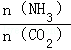 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.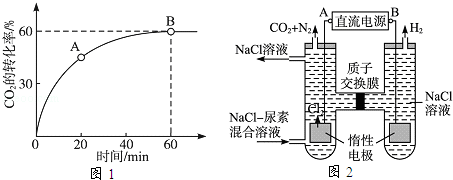
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C,达到化学反应限度时,B的物质的量可能是( )
2C,达到化学反应限度时,B的物质的量可能是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cr2O72- + H2O
Cr2O72- + H2O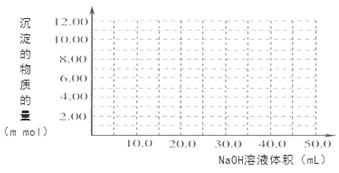
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是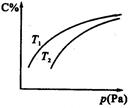
| A.若正反应方向ΔH<0,则T1>T2 |
| B.压强增大时,混合气体的平均相对分子质量减小 |
| C.B一定为气体 |
| D.A一定为气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
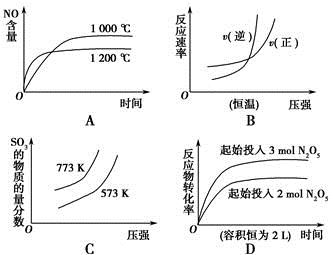
A.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g) ΔH=-b kJ·mol-1 2NH3(g) ΔH=-b kJ·mol-1 |
C.2SO3(g)  2SO2(g)+O2(g) ΔH=+c kJ·mol-1 2SO2(g)+O2(g) ΔH=+c kJ·mol-1 |
D.2N2O5(g)  4NO2(g)+O2(g) ΔH=+d kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
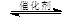 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0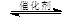 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0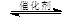 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)| 投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
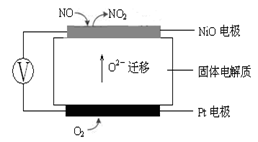
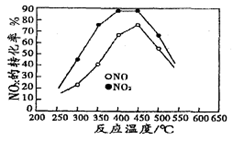
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com