
向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正
确的是
A.溶液中的Na+总数不变 B.溶液中的OH-数目不变
C.溶质的物质的量浓度不变 D.溶液的质量不变
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
如图是常见四种有机物的比例模型示意图。下列说法正确的是
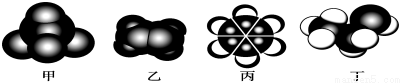
A.甲在一定条件下与氯气混合反应,产物共四种
B.乙可与溴水发生取代反应使溴水褪色
C.丙在一定条件下可与硝酸发生取代反应
D.丁在稀硫酸作用下可与氧气发生催化氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。

请回答:
(1)A转化为B、C时,涉及到的反应类型有 _____、_______________。
(2)E的一种同分异构体Q能在一定条件下发生银镜反应,也能与Na反应放出H2Q结构简式为______。
(3)D的结构简式为__________________。
(4)已知:酰氯能与含有羟基的物质反应生成酯类物质。例如:
 写出草酰氯(分子式C2O2Cl2,
写出草酰氯(分子式C2O2Cl2,
分子结构式: )与足量有机物D反应的最终化学方程式
)与足量有机物D反应的最终化学方程式
_______________________________________________________________。
(5)已知: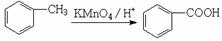
由邻甲基苯酚——中间产物——有机物A,请选择正确中间产物(填B或C) ,并解释原因: 。
B: C:
C:
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别
为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(4c+12b-6a-5d)kJ·mol—1 B.(6a+5d-4c-12b)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积固定的密闭容器中N2 与H2发生反应:N2(g)+3H2(g)  2NH3(g) ,
2NH3(g) ,
达到平衡时c (N2)=3.5 mol·L-1 ,c (H2)=1 mol·L-1 ,c (NH3)=5 mol·L-1 ,求:
(1)N2和H2的起始浓度(4分)
(2)N2的转化率(2分)(要求有解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.氧化铝既能和盐酸反应又能和氢氧化钠溶液反应均生成盐和水,说明氧化铝是两性氧化物。
B.NaHCO3的热稳定性比Na2CO3强
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+
D.氯气中含有的少量氯化氢可用氢氧化钠溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应并不改变的是
A.Na和O2 B.H2S和O2
C.Fe和FeCl3 D.AlCl3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-=4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe=Fe2++2e-
查看答案和解析>>
科目:高中化学 来源: 题型:
新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25 ℃,101 kPa时:C(s)+ O2(g)===CO(g) ΔH=-126.4 kJ·mol-1
O2(g)===CO(g) ΔH=-126.4 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则在25 ℃、101 kPa时:C(s)+H2O(g)===CO(g)+H2(g) ΔH=______________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是______ 。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= ;
②下列措施能使  增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com