
把1 L 0.1 mol/L醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A.c(CH3COOH)变为原来的1/10
B.c(H+)变为原来的1/10
C.c(CH3COO-)/c(CH3COOH)的比值增大
D.溶液的导电性增强
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.葡萄糖不可能由纤维素制取
B.葡萄糖在酒化酶作用下转化为乙醇和二氧化碳
C.葡萄糖是人体能量的重要来源
D.葡萄糖能与银氨溶液发生反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.按系统命名法,化合物 的名称为2,6?二甲基?5?乙基庚烷
的名称为2,6?二甲基?5?乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物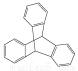 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
在t°C时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。
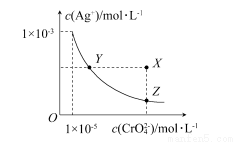
又知AgCl的Ksp=1.8×10-10。
下列说法不正确的是( )
A.t°C时,Ag2CrO4的Ksp为1×10-8
B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
室温下,取0.2 mol·L-1CH3COOH溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是( )
A.混合溶液中由水电离出的c(H+)=10-8 mol·L-1
B.溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.混合溶液中c(Na+)=c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
D.混合溶液中c(OH-)-c(CH3COOH)=c(H+)=1×10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
合成氨尿素工业生产过程中涉及的物质转化过程如下图所示。
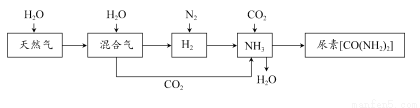
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为___________________________________。
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:___________。
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
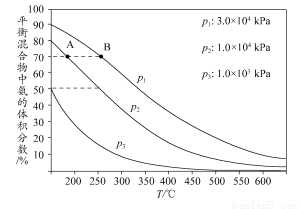
①若分别用vA(NH3)和vB(NH3)表示从反应开始至平衡状态A、B时的化学反应速率,则vA(NH3)________vB(NH3)(填“>”、“<”或“=”)。
②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
③在250°C、1.0×104kPa下,H2的转化率为________%(计算结果保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
在一个固定容积的密闭容器中充入2 mol NO2,一定温度下建立如下平衡:2NO2(g)  N2O4(g),此时平衡混合气中NO2的体积分数为X%,若再充入1 mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为Y%,则X和Y的大小关系正确的是 ( )
N2O4(g),此时平衡混合气中NO2的体积分数为X%,若再充入1 mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为Y%,则X和Y的大小关系正确的是 ( )
A.X>Y B.X<Y C.X=Y D.不能确定
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:填空题
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
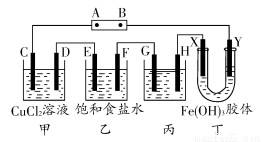
(1)A极为电源的________极。
(2)甲装置中电解反应的总化学方程式是______________。
(3)乙装置中F极附近显红色的原因是______________。
(4)欲用丙装置精炼铜,G应该是________(填“纯铜”或“粗铜”),精炼液的成分是______________________。
(5)已知氢氧化铁胶体中含有带正电荷的红褐色的粒子,那么装置丁中的现象是:
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:填空题
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下图所示:
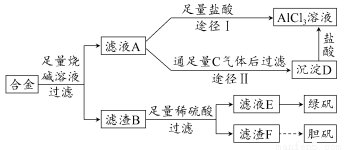
试回答下列问题:
(1)过滤时用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________。
(2)由滤液A制AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是________,理由是_____________________________。
(3)从滤液E中得到绿矾晶体的实验操作是________。
(4)写出用滤渣F制备胆矾晶体的化学方程式_______________________。
(5)有同学提出可将方案中最初用于溶解合金的烧碱改为盐酸,重新设计方案,也能制得这三种物质,你认为后者的方案是否合理?________,理由是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com