
| A. |  | B. |  | C. | 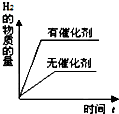 | D. |  |
分析 A、合成氨的反应是放热反应,利用温度对化学平衡的影响及图象来分析;
B、合成氨的反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析;
D、合成氨反应是气体体积缩小的放热反应,则利用压强及其温度对化学平衡的影响,然后结合图象来分析.
解答 解:A、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,所以平衡后,提高温度,逆反应速率增大幅度比正反应速率增大大,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象相符,故B正确;
C、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故C错误;
D、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,又该反应是放热反应,升高温度化学平衡向逆反应反应移动,所以温度高,氨气的体积分数减小,与图象不符,故D错误;
故选B.
点评 本题考查化学平衡与图象,明确影响化学反应速率及化学平衡的影响因素,图象中纵横坐标的含义即可解答.


科目:高中化学 来源: 题型:选择题

| A. | N2(g)与O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 mol O原子结合生成O2(g)时需要吸收498 kJ能量 | |
| C. | 1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量 | |
| D. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444 kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率(10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 样品中含有少量NaCl杂质 | B. | 容量瓶使用前未干燥 | ||
| C. | 定容时俯视容量瓶刻度线 | D. | 在烧杯中溶解时,有少量液体溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-6 mol•L-1的溶液 | B. | pH<7的溶液 | ||
| C. | c(H+)>c(OH-)的溶液 | D. | 滴加酚酞显无色的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com