
����Ŀ����̼���ƣ�Na2CO4����ϴ�ӡ�ӡȾ����֯����ֽ��ҽҩ�����������д���Ӧ�ã�ij��ѧ�о���ѧϰС����Ʋ����������ʵ�飺
��ʵ��Ŀ�ġ��ⶨ��̼������Ʒ�����е����ʲ�����ˮ�Ҳ����ᷴӦ���Ĵ��ȣ�
��ʵ��ԭ����2Na2CO4+4HCl�T4NaCl+2CO2��+O2��+2H2O
��ʵ��װ�á�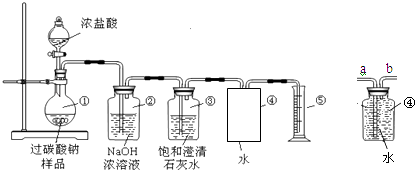
�����������ۡ�
��1����ͬѧ��Ϊ�ⶨ������O2��������ɲⶨ��Ʒ�Ĵ��ȣ�
װ�âڵ������ǣ���
��2��װ�â۵������ǣ� ��
����װ�â۵Ķ̵���Ӧ��װ�âܵ��ӿ��������a����b������
��3����ȡ������Ʒ������Ũ�����ַ�Ӧ���ռ��������������Ϊ3.36L����״���£������ȡ����Ʒ����Ӧ����g��
��4������ͬѧ��Ϊ�ⶨ������CO2������������Ӧǰ��װ�âڵ�������Ϳɲⶨ��Ʒ�Ĵ��ȣ�����������ʵ��װ�ò��CO2��������������Ʒ�Ĵ��ȣ�������ܻ�ƫ�ߣ�����Ϊԭ�������������ţ�
A��Ũ�����ӷ����������Ȼ������屻װ�â�����
B��������̼�����ݳ�ʱ������ˮ������װ�â���������������
C��װ�â١����ڿ����еĶ�����̼��װ�â�����
����ͬѧ��Ϊ����ͬѧ�ķ�����õ���Ʒ����Ҳ���ܻ�ƫ�ͣ�����Ϊԭ������ǣ���֪װ�ò�©�����Լ�������
��5����ͬѧ�����һ���·������õ��˴�ҵ�һ���Ͽɣ���ȡ��Ʒ12.5g���μ�����Ũ��������Ʒ��Ӧ��ȫ���ٽ���ƿ�����е�Һ���������ᾧ����ɣ��Ƶ�ʣ�����11.7g�������Ʒ�Ĵ���Ϊ ��
���𰸡�
��1����ȥ������̼���Ȼ�������
��2����֤������̼�Ƿ���,b
��3��36.6
��4��ABC,�٢�װ���ڻ��в����CO2δ��NaOH��Һ����
��5��97.6%
���������⣺��1��װ�â���Ũ�������Ƶ������dz�ȥ������̼���Ȼ������壬
���Դ��ǣ���ȥ������̼���Ȼ������壻
��2��װ�â��г���ʯ��ˮ����������֤������̼�Ƿ���������װ�â۵Ķ̵���Ӧ��װ�âܵ�b���������ӣ���Һ���������ⶨ���������
���Դ��ǣ���֤������̼�Ƿ�����b��
��3�����ռ��������������Ϊ3.36L����4.8g������Ҫ��̼���Ƶ�����Ϊx��
2Na2CO4+4HCl�T4NaCl+2CO2��+ | O2��+2H2O |
244 | 32 |
x | 4.8g |
![]() =
= ![]()
x=36.6g��
װ���к���Һ�����л���ģ���ȡ����Ʒ����Ӧ����36.6g��
���Դ��ǣ�36.6��
��ö�����̼�����ƫ��ԭ������У�Ũ�����ӷ����������Ȼ������屻װ�â����գ�������̼�����ݳ�ʱ������ˮ������װ�â��������������գ�װ�â١����ڿ����еĶ�����̼��װ�â����գ�����ABC��ȷ��
��ͬѧ��Ϊ����ͬѧ�ķ�����õ���Ʒ����Ҳ���ܻ�ƫ�͵�ԭ��Ϊ�٢�װ���ڻ��в����CO2δ��NaOH��Һ���գ�
���Դ��ǣ�ABC���٢�װ���ڻ��в����CO2δ��NaOH��Һ���գ�
������Ʒ�й�̼���Ƶ�����Ϊy��
2Na2CO4+4HCl�T | 4NaCl+2CO2��+O2��+2H2O |
244 | 234 |
y | 11.7g |
![]() =
= ![]() ��y=12.2g
��y=12.2g
����Ʒ�Ĵ���Ϊ�� ![]() ��100%=97.6%��
��100%=97.6%��
���Դ��ǣ�97.6%��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�����ʴ��������ȷ���ǣ�������
A.�����ǣ�M+nH2O=M��OH��n+ ![]() H2��
H2��
B.�绯ѧ��ʴ���������������½���
C.��ѧ��ʴ�ȵ绯ѧ��ʴ���ձ�
D.�����ǣ�M��ne��=Mn+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�dz����ѱ����֮һ������ͨ���ⶨ������ˮ��I�ĺ����仯�����˵�վ�Ƿ�������������й©�������й�I�������д������(����)
A.I�Ļ�ѧ������I��ͬ
B.I��ԭ������Ϊ53
C.I��ԭ�Ӻ��������Ϊ78
D.I��ԭ�Ӻ�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ԭ�ӵ������ܼ����Ų�ʱ�����һ���Ų�����(����)
A.ns
B.np
C.(n��1)d
D.(n��2)f
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A��B��C����װ�õ��ձ��зֱ�ʢ��������CuCl2��Һ��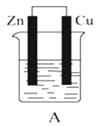
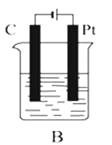
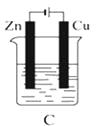
��1��A��B��C����װ��������ԭ��ص������ڵ��ص��� ��
��2��A����Zn������Cu�����������������ԭ������Ӧ���缫��ӦΪ �� ��Ӧ������Һ��c��Cu2+����������С�����䡱����
��3��B����C��������һ��ʱ��������Ϊ �� �缫��ӦΪ �� B ���е��ܷ�ӦΪ ��
��4��C���ڻ�ѧ��Ӧ�з���������ת����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ��ش��������⣮
��1������ͼ1�ش�٢ڣ�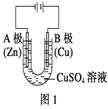
��A�缫�ɹ۲쵽�������� �� �缫��ӦʽΪ��B���ĵ缫��ӦʽΪ ��
��ͨ��һ��ʱ���CuSO4��Һ��Ũ�� �� pH����������С�����䡱����
��2������ͼ2�ش�ۢܣ�
�۽��ϴ�����CuSO4��Һ������ͼ��ʾ��װ���н��е�⣬ʯī�缫�ϵĵ缫��ӦʽΪ �� ��ⷴӦ�����ӷ���ʽΪ ��
��ʵ����ɺ�ͭ�缫����a g��ʯī�缫������״���µ��������L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʲ�����ͬ���칹�����
A. �����Ǻ���B. ���ۺ���ά��C. ���Ǻ���ѿ��D. �������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���淴Ӧ2A��g��+3B��g��4C��g��+D��g������֪��ʼŨ��c��A��=2mol/L��c��B��=3mol/L��c��C��=c��D��=0����Ӧ��ʼ20min��ﵽƽ��״̬����ʱD��ƽ��Ũ��Ϊ0.5mol/L��������˵������ȷ���ǣ� ��
A.ǰ20 min��ƽ����Ӧ����v��C��=0.1 mol/��Lmin��
B.A��ת����Ϊ50%
C.C��ƽ��Ũ��c��C��=4 mol/L
D.B��ƽ��Ũ��c��B��=1.5 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������;ʮ�ֹ㷺�������������뵼����Ϲ裬������������ͼ������˵������ȷ���ǣ������� ![]()
A.�٢����û���Ӧ�����ǻ��Ϸ�Ӧ
B.�����£���̿�������Ļ�ԭ�Ծ�ǿ�ڹ��
C.��һ��Ӧ�У�ÿ���Ļ�����28 g�裬��ת��4 mol����
D.�����½�ʯӢɰ����̿��������������һ��������Ͽɵøߴ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com