
【题目】下图是氯化钠晶体和二氧化碳晶体的结构示意图,关于两种晶体说法正确的是
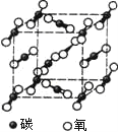
A.两种晶体内均含有共价键B.构成两种晶体的微粒均是原子
C.两种晶体均属于离子晶体D.两者的硬度、熔沸点差别较大
科目:高中化学 来源: 题型:
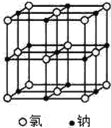
【题目】用如图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A.棉花球处发生的离子反应是Cl2+H2O = H++Cl-+HClO
B.大量白烟是氯化钠固体小颗粒
C.钠着火燃烧产生黄色火焰
D.可在棉花球右侧用湿润的淀粉KI试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展。
(1)写出工业上冶炼金属镁的化学方程式__。
(2)某研究性小组探究以镁条、铝片为电极,稀氢氧化钠溶液为电解质溶液构成的原电池(如图所示),刚开始时发现电表指针向左偏转,镁条作负极,且镁条附近出现浑浊;但随后很快指针向右偏转,铝条溶解。
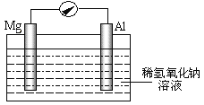
①开始阶段,镁条发生的电极反应式为__,指出其反应类型为__(填“氧化”或“还原”)。
②随后阶段,铝片发生的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如下图所示。下列说法中正确是
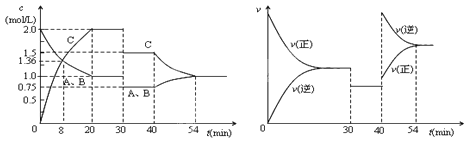
A.前8min A的平均反应速率为0.08mol/(L·s)
B.30min时扩大容器的体积,40min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.30min和54min的反应的平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
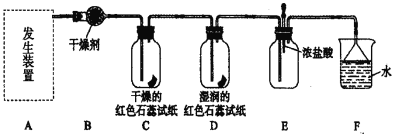
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。[制取氨气的反应原理:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+2H2O ]
CaCl2 + 2NH3↑+2H2O ]
(实验探究)
(1)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。

(2)B装置中的干燥剂可选用________。
(3)用5.35 g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为________ L。(NH4Cl的摩尔质量为53.5g·mol—1)
(4)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______。
(6)F装置中倒置漏斗的作用_______。
(拓展应用)
(7)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
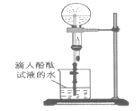
a 还原性 b 极易溶于水 c 与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 =7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2碱性溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/mol·L1 | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2碱性溶液脱硝(NO)过程中主要反应的离子方程式:____。增加压强,NO的转化率___(填“提高”“不变”或“降低”)
②由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
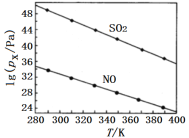
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___(填“增大”“不变”或“减小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度是1.16 g·L1,B的产量可以用来衡量一个国家石油化工发展水平,G是一种高分子化合物。现有 A、B、C、D、E、F、G 存在如下关系:
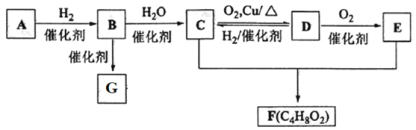
请回答:
(1)D中的官能团名称是_______________。 B的结构式为_________;
(2)写出 C+E→F反应的化学方程式__________;
(3)写出 C→D反应的化学方程式为__________;
(4)已知三分子 A 在一定条件下可合成不能使酸性 KMnO4 溶液褪色的有机物,写出该合成反应的化学方程式___________,反应类型为___________。
(5)下列有关叙述正确的是_____________。
a. A、B、C、D、E、F、G均为非电解质
b. A中所有原子不可能处于同一平面上
c. 加热时,D 能与新制氢氧化铜悬浊液反应生成砖红色沉淀
d.75%(体积分数)的 C 水溶液常用于医疗消毒
e. 将绿豆大小的钠块投入 C 中,钠块浮于液面上,并有大量气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com