
【题目】氰基烯酸酯在碱性条件下能快速聚合为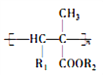 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
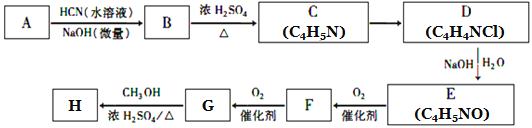
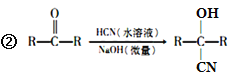
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
【答案】 丙酮 ![]() 醛基 氧化反应 取代反应(酯化反应)
醛基 氧化反应 取代反应(酯化反应) ![]() + CH3OH
+ CH3OH ![]()
![]() + H2O CH3CH2CHO
+ H2O CH3CH2CHO
【解析】试题分析:(1)A的相对分子量为58,氧元素质量分数为0.276,则氧原子个数是58×0.276÷16=1,再根据商余法42÷12=3…6,A的分子式是C3H6O,核磁共振氢谱显示为单峰,A是CH3COCH3;(2)A是CH3COCH3,根据信息②,可知B是![]() ;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是
;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是![]() ;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是
;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是![]() ;逆推G是
;逆推G是![]() ;F是
;F是![]() ;E是
;E是![]() ;D是
;D是![]() 。
。
解析:根据以上分析,(1)A是CH3COCH3,化学名称为丙酮。
(2)C的结构简式为![]() ,F是
,F是![]() 含氧官能团是-CHO,名称是醛基。
含氧官能团是-CHO,名称是醛基。
(3)由![]() →
→![]() 的反应类型为氧化反应,
的反应类型为氧化反应,![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应类型为酯化反应。
的反应类型为酯化反应。
(4)![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应方程式为
的反应方程式为![]() + CH3OH
+ CH3OH ![]()
![]() + H2O。
+ H2O。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的性质比较,不正确的是
A. 酸性:HClO4>H2SO4>H3PO4 B. 稳定性:NH3<PH3<SiH4
C. 碱性:KOH>NaOH>Mg(OH)2 D. 还原性:F﹣<Cl﹣<Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合溶液中,能观察到的现象是: ①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH﹣ ![]() ?NH3↑+H2O
?NH3↑+H2O
B.将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2﹣═2Fe2++S↓
C.向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++4H++NO3﹣═3Fe3++2H2O+NO↑
D.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO﹣+H2O+CO2═CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列7种物质:①NaOH、②NaHCO3、③HCl、④CH3COOH、⑤C2H5OH、⑥Al、⑦食盐水。
(1)上述物质中属于强电解质的是________(填序号),属于弱电解质的是________(填序号),属于非电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是____________(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) ______________________。
(3)上述④的水溶液呈酸性的原因是(用离子方程式表示)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2O![]() Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+离子的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
A. X>Y>Z>W B. Y>X>W>Z
C. Z>X>Y>W D. Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②纯碱和熟石灰都是碱;③冰和干冰都既是纯净物又是化合物;④盐酸和食醋既是化合物又是酸;⑤豆浆和雾都是胶体。上述说法正确的是( )
A. ①②③ B. ①②⑤ C. ③④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式________。
,请写出此反应的热化学方程式________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则该电池的正极反应式为________。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)。已知不同温度对CO2的转化率及催化剂的效率影响如右图所示,下列有关说法不正确的是________(填序号)。
CH2=CH2(g)+4H2O(g)。已知不同温度对CO2的转化率及催化剂的效率影响如右图所示,下列有关说法不正确的是________(填序号)。

①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5 mol CO和4 mol NO,发生上述(1)中某反应,下图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度:T1________T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2 L,则此时的平衡常数K=________(结果精确到两位小数);用CO的浓度变化表示的平均反应速率v(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com