
| 化合物 | 甲 | 乙 | 丙 |
| 组成元素 | B、C | A、C | C、D |
分析 (1)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、D元素同主族且A是原子半径最小的元素,所以A是氢元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍,所以是碳;,由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲物质为有剧毒的气体,密度略小于空气;且B、C同周期,则甲是CO,所以B是C、C是O元素;
乙物质为液体,乙是A、C元素组成,则乙是H2O2,D与A同一主族,且原子序数D大于C,所以D是Na元素;
由C、D组成,且原子个数之比为1:1,则丁是Na2O2,再结合物质结构、性质解答;
(2)①S(s)+O2(g)=SO2(g)△H=a kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
由盖斯定律目标反应的△H=2②-①;
(3)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
(4)①甲醇发生氧化反应,在碱性条件下生成碳酸根离子与水;
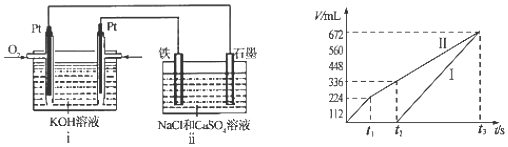
②图1中原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu,故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑.
解答 解:(1)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、D元素同主族且A是原子半径最小的元素,所以A是氢元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍,所以是碳;,由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲物质为有剧毒的气体,密度略小于空气;且B、C同周期,则甲是CO,所以B是C、C是O元素;
乙物质为液体,乙是A、C元素组成,则乙是H2O2,D与A同一主族,且原子序数D大于C,所以D是Na元素;
由C、D组成,且原子个数之比为1:1,则丁是Na2O2,甲的化学式为CO,乙的化学式为H2O2,丙的化学式为Na2O2,其中丙中阴离子与阳离子的个数之比为1:2,故答案为:CO;H2O2;Na2O2;1:2;
(2)①S(s)+O2(g)=SO2(g)△H=a kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=b kJ/mol
由盖斯定律目标反应的△H=2②-①=(2b-a)kJ/mol,故答案为:2b-a;
(2)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ•moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ•moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ•moL-1-(-483.6KJ•moL-1)=-82.4KJ•moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1,
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1;
(4)①在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②图1中原电池通入甲醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu,故图2中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,
故答案为:阴极; 4OH--4e-=O2↑+2H2O (或2H2O-4e-=O2↑+4H+).
点评 本题考查了元素化合物的知识、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适,是一类治疗胃痛的药 | |
| B. | 碳酸镁、碳酸钡都能制成抗酸药 | |
| C. | 青霉素有阻止多种细菌生长的优异功能,虽经1×107 倍稀释,仍有疗效 | |
| D. | 青霉素是重要的消炎药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中可能含有K+,一定没有HCO3-和OH-,将产生的无色气体通入澄清石灰水中,澄清石灰水变浑浊 | |
| B. | 原溶液中一定含有Cl-和NO3-,可能含有SO42-,反应生成的无色气体遇空气变红棕色 | |
| C. | 原溶液中所含的阳离子为Mg2+、Fe2+,加入稀盐酸所发生的反应为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 若向原溶液中加入过量NaOH溶液,将所得沉淀过滤、洗涤、灼烧到恒重,得到的固体质量为107 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 | |
| B. | 用KSCN溶液鉴别Fe3+和Fe2+ | |
| C. | 用NaOH溶液和红色石蕊试纸鉴别溶液是否含NH4+ | |
| D. | 在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com