
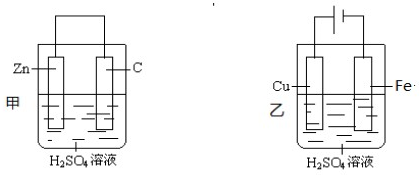
 .
.

 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
A、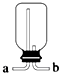 从a口进气可收集Cl2、NO2等气体 |
B、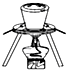 在海带提碘实验中用于灼烧海带 |
C、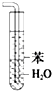 可用于吸收氨气能够防止倒吸 |
D、 用于分离互不相溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的化合物称为二肽,二肽还可以继续与其它α-氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成
的化合物称为二肽,二肽还可以继续与其它α-氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
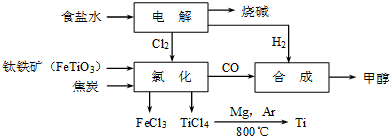
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
B、工业制备氯气:2NaCl+2H2O
| ||||
| C、金属钠与足量盐酸反应:2Na+2H+=2Na++H2↑ | ||||
| D、硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉有氢气产生的溶液中:Na+、SO42-、C1-、K+ |
| B、pH=0的无色溶液中:Na+、K+、MnO4-、NO3- |
| C、在0.1mol/L的盐酸溶液中:Fe2+、Na+、ClO-、Ca2+ |
| D、在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com