
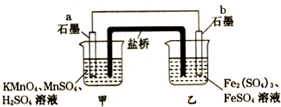
 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )| A. | 外电路电子的流向是从a到b | |
| B. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| C. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 双液原电池工作时产生大量的热量 |
分析 由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,外电路中电流从正极流向负极,电子由负极移向正极,阴离子向负极移动,原电池中化学能主要转化为电能,产生的热量很小.
解答 解:A.由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,外电路中电子由负极移向正极,即外电路电子的流向是从b到a,故A错误;
B.阴离子向负极移动,则盐桥中的SO42-移向乙烧杯中,故B错误;
C.甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4-+8H++5e-═Mn2++4H2O,故C正确;
D.原电池中化学能主要转化为电能,产生的热量很小,故D错误,
故选:C.
点评 本题考查原电池的工作原理,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
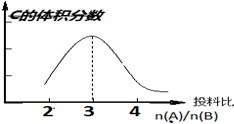 在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:
在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
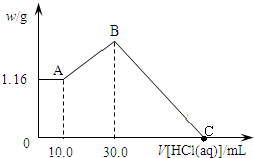
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
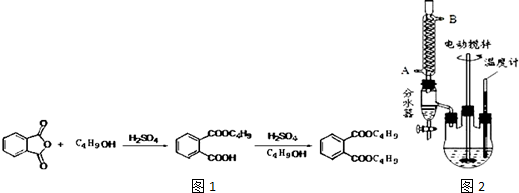
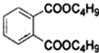 +2NaOH$\stackrel{加热}{→}$
+2NaOH$\stackrel{加热}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+ NH4+ Fe2+ Mg2+ Al3+ Cu2+ |
| 阴离子 | OH- Cl- Al02- CO32- SiO32-SO42- |
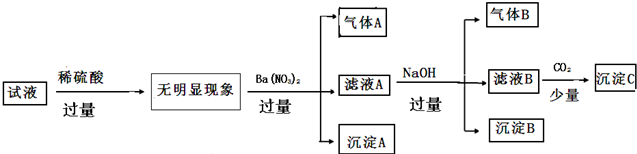
| A. | 原溶液中只含有NH4+ Fe2+Cl- SO42- | |
| B. | 由沉淀A推断原溶液中一定含有SO42- | |
| C. | 滤液A中可能含有K+ Al3+ Cl- | |
| D. | 沉淀B中一定含有Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com