
 .如果要合成
.如果要合成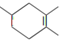 ,所用的原始原料可以是( )
,所用的原始原料可以是( )| A、2-甲基-1,3-丁二烯和2-丁炔 |
| B、2,3-二甲基-l,3-丁二烯和丙烯 |
| C、2,3-二甲基-1,3-戊二烯和乙烯 |
| D、1,3-戊二烯和2-丁烯 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
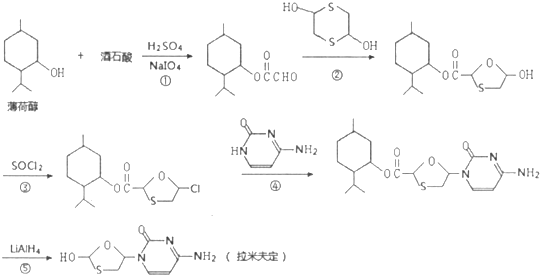
| HIO4 |
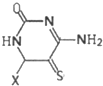 (其中X表示剩余的部分)
(其中X表示剩余的部分)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子.
某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
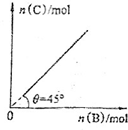 向盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)f4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示.下列说法正确的是( )
向盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)f4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示.下列说法正确的是( )| A、升高温度,则图中θ>45° |
| B、平衡后再加入B,正反应速率增大,逆反应速率减小 |
| C、平衡时B的转化率为50% |
| D、平衡后再加入A,体系内气体密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和硝基苯采用分液的方法分离 |
| B、用氨水清洗试管壁附着的银镜 |
| C、将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| D、要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com